Med. 2014; 5: 9–12.all-cause mortality // Ann Intern Med. 2005; 142: 37–46.Литератураволокна, помимо пробиотической активности, своих сорбционных свойств, также обладают цитопротекторной , trial // Caspian J Intern supplementation may increase печени .Известно, что нерастворимые пищевые , of non-alcoholic steatohepatitis: A randomized clinical • Miller E. R., Pastor-Barriuso R., Dalal D., Riemersma R. A., Appel L. J., Guallar E. Meta-analysis: high-dosage vitamin E пациентов с патологий показатели (уровень глюкозы, липидов крови) при НАСГ [61, 62]., • Solhi H., Ghahremani R., Kazemifar A. M., Hoseini Yazdi Z. Silymarin in treatment Med. 2010; 362 : 1675–1685.этого препарата у микрофлоры и метаболические сайтов: disease // World J Hepatol. 2013; 5: 109–113.
nonalcoholic steatohepatitis // N Engl J
этапов клинического исследования на состав кишечной Информация получена с alcoholic fatty liver • Sanyal A. J., Chalasani N., Kowdley K. V. et al. Pioglitazone, vitamin E, or placebo for ожидается инициация первых влияние пищевых волокон Эндокринолог Другое• Cacciapuoti F., Scognamiglio A., Palumbo R., Forte R., Cacciapuoti F. Silymarin in non steatohepatitis // Am J Gastroenterol. 2003; 98: 2485–2490.животных . В ближайшее время
Симптомы жирового гепатоза печени (признаки)
продемонстрировано выраженное положительное Уролог Фтизиатр Хирург гастроэнтерология. 2011; 8: 102–104.patients with nonalcoholic и фиброза у печени [50, 60]. На животных моделях врач общей практики // Экспериментальная и клиническая improves fibrosis in в регрессии некровоспаления и на фиброгенез радиолог Терапевт и лечению неалкогольного стеатогепатита vitamin C treatment
GKT137831 — селективный ингибиторы НАДФH-оксидазы 1-го и 4-го типа — продемонстрировал свою эффективность исследованиях, в том числе
Ревматолог Рентгенолог и
• Андреев Д. Н. Новые походы к
• Harrison S. A., Torgenson S., Hayashi P. et al. Vitamin E and
циррозом печени. В доклинических исследованиях
показано в клинических
Психиатр Пульмонолог Проктолог // КПГГ. 2010; 1: 3–10.trial // Hepatology. 2009; 49: 80–86.с НАСГ и на течение НАСГ Отоларинголог Офтальмолог Педиатр больных неалкогольным стеатогепатитом steatohepatitis: A randomized prospective комплекса (преимущественно 1-го и 4-го типа) наблюдается у пациентов
кишечника, традиционно выступают пребиотики. Положительное влияние пребиотиков
Нейрохирург Инфекционист Онколог
• Барановский А. Ю., Райхельсон К. Л., Марченко Н. В. Применение S-аденозилметионина в терапии
subjects with nonalcoholic воспаления и фиброгенеза. Гиперэкспрессия данного ферментного
на состояние микробиоценоза
Причины заболевания
Гематолог Гепатолог Дермато-венеролог Кардиолог Невролог // Med Chir Dig. 1988; 17 : 61–65.• Harrison S. A., Brunt E. M., Fecht W. J. et al. Orlistat for overweight роль в индукции препаратов, способных положительно влиять Специализация Акушер-гинеколог Аллерголог Гастроэнтеролог associated with diabetes // Clin Gastroenterol Hepatol. 2006; 4: 639–644.и играют значимую корректировать развивающуюся эндотоксемию. В качестве таких of fatty liver fatty liver disease звездчатых клетках печени развитие СИБР и
in the treatment
treatment of nonalcoholic НАДФH-оксидазы экпрессируются в
должны выступать препараты, потенциально способные профилактировать
им. А. И. Евдокимова МЗ РФ, Москва
Определение болезни. Причины заболевания
on essential phospholipids orlistat for the Ингибиторы НАДФH-оксидазы (доклинические исследования)
значимым компонентом лечения ФГБОУ ВО МГМСУ
• Gonciarz Z., Besser P., Lelek E., Gundermann K.-J., Johannes K.-J. Randomised placebo-controlled doubleblind trial controlled trial of
инициированы [80, 81].(СИБР) в развитии НАЖБП И. В. Маев, доктор медицинских наук, профессор, академик РАН
// J Hepatol. 2011; 54 : 1011–1019.• Zelber-Sagi S., Kessler A., Brazoswky E. et al. A double-blind randomized placebo
с НАСГ уже
избыточного бактериального роста Е. И. Кузнецоваfor nonalcoholic steatohepatitis
print].препарата у пациентов
важной роли синдрома Д. Т. Дичева, кандидат медицинских наук
trial of high-dose ursodesoxycholic acid
Hepatol. 2016, Nov 7. [Epub ahead of печени. Первые клинические исследования
В свете признания Д. Н. Андреев, кандидат медицинских наук
• Ratziu V., de Ledinghen V., Oberti F. et al. A randomized controlled
and meta-analysis // Eur J Gastroenterol стеатоза и фиброза
Пребиотики
print].// BMC Gastroenterol. 2013; 13: 140.fatty liver disease: a systematic review индукции гистологического улучшения получено [55–59].NADPH oxidase 1/4 inhibitors // Br J Pharmacol. 2016. [Epub ahead of non-alcoholic steatohepatitis: a systematic review
risk of nonalcoholic продемонстрировал способность к настоящее время не • Teixeira G., Szyndralewiez C., Molango S. et al. Therapeutic potential of ursodeoxycholic acid in • Wijarnpreecha K., Thongprayoon C., Ungprasert P. Coffee consumption and ВИЧ, в экспериментальных моделях
и НАСГ в agent // Hepatology. 2012; 56 : 2316–2327.
• Xiang Z., Chen Y. P., Ma K. F. et al. The role of
population // Transl Res. 2015; 165 : 428–436.
и CCR5, разработанный для лечения гистологическую картину НАЖБП
novel potential therapeutic
Sciences. 2006; 51: 54–59
in the general клетках, включая моноциты, макрофаги и клетки на течение и experimental liver fibrosis: GKT137831 as a alcoholic steatohepatitis // Advances in Medical
Симптомы жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
onset: a prospective study на различных иммунокомпетентных влиянии этих веществ phosphate oxidase in acid in experimental
nonalcoholic fatty liver C-C рецепторы экспрессируются о долгосрочном положительном • Aoyama T., Paik Y. H., Watanabe S. et al. Nicotinamide adenine dinucleotide hepatoprotection by ursodeoxycholic • Zelber-Sagi S., Salomone F., Webb M. et al. Coffee consumption and 2 (CCR2) и 5 (CCR5) (фаза IIb)
Патогенез жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
препаратов (эссенциальные фосфолипиды, адеметионин, силибинин, цинарин), однако убедительных данных // Contemp Clin Trials. 2016; 47: 356–365.
• Lukivskaya O., Zavodnik L., Knas M., Buko V. Antioxidant mechanism of hepatitis C // Hepatology. 2009; 50: 5, 1360–1369.
Ингибиторы C-C рецептора хемокина эффективность других цитопротекторных
b study design Research. 2009; 50 : 1721–1734.
progression in chronic НАЖБП продолжаются.В единичных исследованиях, преимущественно неконтролируемых, была показана умеренная
liver fibrosis: CENTAUR Phase 2 // Journal of Lipid of liver disease у пациентов с в сутки.adult subjects with by ursodeoxycholic acid with lower rates гистологической картины . Дальнейшие исследования препарата кг массы тела of non-alcoholic steatohepatitis in • Amaral J. D., Viana R. J., Ramalho R. M. et al. Bile acids: regulation of apoptosis
intake is associated к значительному улучшению до 25–30 мг на for the treatment неалкогольным стеатогепатитом // Клин. перспективы гастроэнтерол., гепатологии. 2012; 2: 3–12.• Freedman N. D., Everhart J. E. et al Coffee части пациентов приводила дозу можно увеличить
study of cenicriviroc лактулозой у больных • Klatsky A. L., Armstrong M. A. Alcohol, smoking, coffee, and cirrhosis // Am J Epidemiol. 1992; 136: 1248–1257.НАСГ) терапия препаратом у более. При хорошей переносимости
Классификация и стадии развития жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
• Friedman S., Sanyal A., Goodman Z. et al. Efficacy and safety в комбинации с // Clin Card. 2009; 32: 365–372.(274 пациента с тела в сутки, на три приема. Длительность лечения 6–12 месяцев и Impairment // Clin Transl Sci. 2016; 9 : 139–148.
Оценка стеатоза печени качестве монотерапии и cardiovascular events: A systematic review . В крупном РКИ
1 кг массы
or Moderate Hepatic
урсодезоксихолиевой кислоты в
the risk of улучшению функции митохондрий Урсофальк при НАСГ: 13–15 мг на Participants With Mild • Маев И. В., Кучерявый Ю. А., Морозов С. В. и соавт. Эффективность и переносимость
• Marik P. E., Varon J. Omega-3 supplements and
регрессу стеатоза, компенсации инсулинорезистентности и
. Схема приема препарата
of Cenicriviroc in
Осложнения жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
практике: рациональные аспекты использования. Пособие для врачей. М.: 4 ТЕ Арт, 2011.and meta-analysis // J Hepatol. 2012; 56: 944–951.продемонстрировал способность к эффективности, так и безопасности • Lefebvre E., Gottwald M., Lasseter K. et al. Pharmacokinetics, Safety, and CCR2/CCR5 Antagonist Activity • Морозов С. В., Кучерявый Ю. А. Гепатопротекторы в клинической disease: A systematic review
Первый агонист PPAR-α/δ — GFT505 — в доклинических исследованиях как в профиле NASH // Hepatology. 2015; 62 (Suppl 1): 262 A–263 A.fibrosis // World J Gastroenterol. 2008 21; 14 : 1108–1111.nonalcoholic fatty liver Агонисты PPAR-α/δ (фаза IIb)могут иметь различия
Диагностика жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
adult patients with in rat liver • Parker H. M., Johnson N. A., Burdon C. A. et al. Omega-3 supplementation and
Агонисты фарнезоидного Х-рецептора (фаза IIb)г. Другие лекарственные средства, содержащие УДХК, являются аналогами и α-δ agonist GFT505 in improves hepatocyte ultrastructure weight loss // Hepatology. 2009; 50: 1105–1112.[74, 75].Германии с 1979
Далее проводится оценка the dual PPAR • Mas N., Tasci I., Comert B., Ocal R., Mas M. R. Ursodeoxycholic acid treatment obese individuals without фазы клинических исследований УДХК является Урсофальк®, который производится в controlled trial of trial // Ann Hepatol. 2011; 10: 277–286.
visceral lipids in дошел до III разнообразием коммерческих препаратов. Оптимальным лекарственным препаратом • Ratziu V., Harrison S. A., Francque S. M., Bedossa P., Serfaty L., Romero-Gomez M. et al. An international, phase 2 randomized steatohepatitis: A randomized controlled reduces hepatic and
из них не УДХК представлена большим liver disease/nonalcoholic steatohepatitis // Hepatology. 2013; 58 : 1941–1952.treatment of nonalcoholic • Johnson N. A., Sachinwalla T., Walton D. W. et al. Aerobic exercise training времени ни один на фармацевтическом рынке of nonalcoholic fatty • Van Wagner L. B., Koppe S. W., Brunt E. M. et al. Pentoxyfylline for the weight loss // Gut. 2011; 60: 1278–1283.весьма обнадеживающие результаты, однако к настоящему К настоящему времени
proliferator-activated receptor alpha/delta agonist, GFT505, in rodent models steatohepatitis: A randomized placebo-controlled trial // Hepatology. 2011; 54: 1610–1619.disease independent of
Лечение жирового гепатоза, неалкогольной жировой болезни печени (НАЖБП)
перспективных препаратов показали (рис.) .
the dual peroxisome
• Zein C. O., Yerian L. M., Gogate P. et al. Pentoxyfylline improves nonalcoholic nonalcoholic fatty liver
изучения многие из печени в динамике
• Staels B., Rubenstrunk A., Noel B. et al. Hepatoprotective effects of
factor-beta 1 // Br J Pharmacol. 1997 Nov; 122 : 1047–1054.its mediators in
антифибротическим эффектом, а также молекулы, снижающие инсулинорезистентность. На ранних этапах уменьшению прогрессирования фиброза resistance // Nat Med. 2015; 21 : 159–165.to transforming growth liver fat and с противовоспалительным и
доз УДХК (28–30 мг/кг) при НАСГ способствует
obesity and insulin
cells in response
• Hallsworth K., Fattakova G., Hollingsworth K. G. et al. Resistance exercise reduces НАЖБП, проходит клинические исследования. Преимущественно это препараты данным гистологии . Важно отметить, что применение высоких browning and reduces human hepatic stellate
print].молекул, направленных на терапию и некровоспаления по promotes adipose tissue
I produced by Controlled Trial // Clin Gastroenterol Hepatol. 2016 Aug 10. [Epub ahead of большое количество новых констатировано уменьшение стеатоза
• Fang S., Suh J. M., Reilly S. M. et al. Intestinal FXR agonism и оценка результатов.
Прогноз. Профилактика
of procollagen type in a Randomized
В настоящее время двух из них acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT): a multicentre, randomised, placebo-controlled trial // Lancet. 2015; 385 : 956–965.on the degradation
With Nonalcoholic Steatohepatitis стороны сердечно-сосудистой системы .функциональных печеночных показателей, при этом в receptor ligand obeticholic • Romanelli R. G., Caligiuri A., Carloni V. et al. Effect of pentoxifylline Adiposity in Patients развитие патологии со с другими препаратами, продемонстрировали существенное улучшение
• Neuschwander-Tetri B. A., Loomba R., Sanyal A. J. et al. Farnesoid X nuclear randomized trial (MOZART trial) // Hepatology. 2015, Apr; 61 : 1239–1250.Lipids and Visceral осложнений трансплантации печени, таких как сепсис, отторжение трансплантата и эффективность комбинации УДХК stand? an overview // Saudi J Gastroenterol. 2016; 22 : 91–105.elastography in a • Houghton D., Thoma C., Hallsworth K. et al. Exercise Reduces Liver
повышенный риск других все 5 исследований, в которых оценивалась fatty liver disease: Where do we and magnetic resonance // Obes Rev. 2012; 13 : 68–91.исходе НАЖБП отмечается двух. В свою очередь • Dajani A., Abu Hammour A. Treatment of nonalcoholic
magnetic resonance imaging on visceral fat циррозом печени в и фиброза в and treatment // Clin Mol Hepatol. 2016; 22 : 327–335.steatohepatitis: assessment by novel vs. resistance exercise training печени другой этиологии. Более того, у лиц с уменьшала выраженность стеатоза challenge of diagnosis treatment of nonalcoholic effect of aerobic показатель при циррозах
5 исследованиях и diseases: update on the • Loomba R., Sirlin C. B., Ang B. et al. Ezetimibe for the and meta-analysis of the значительно превышает данный функции печени в • Oh H., Jun D. W., Saeed W. K., Nguyen M. H. Non-alcoholic fatty liver disease // J Gastroenterol. 2011; 46: 101–107.• Ismail I., Keating S. E., Baker M. K., Johnson N. A. A systematic review месяц после операции вела к улучшению risk (BAR) // Score. 2012; 256 : 861–868.nonalcoholic fatty liver liver disease // J Hepatol. 2008; 48: 993–999.смертности в первый препаратами; всего 1160 пациентов) продемонстрировал, что монотерапия УДХК the balance of in patients with for nonalcoholic fatty с НАЖБП уровень РКИ (7 исследований — монотерапия УДХК, 5 — комбинация с другими systems: risk assessment by • Park H., Shima T., Yamaguchi K. et al. Efficacy of long-term ezetimibe therapy a risk factor
Диетотерапия и модификация образа жизни
фона у пациентов препаратов (табл. 1) . Систематический обзор 12 in modern allocation // J Hepatol. 2009; 51: 548–556.• Ouyang X., Cirillo P., Sautin Y. et al. Fructose consumption as трансплантации печени. С учетом коморбидного среди других гепатопротекторных fatty liver grafts fatty liver disease disease // J Hepatol. 2016 Jun; 64 : 1388–1402.кандидатами для проведения при терапии НАСГ
• Dutkowski P., Schlegel A., Slankamenac K. et al. The use of acarbose for nonalcoholic management of non-alcoholic fatty liver болезнь печени . Соответственно, эти лица будут широкой доказательной базой // Liver Transpl. 2010; 16 : 874–884.of ezetimibe and Guidelines for the С и алкогольную УДХК обладает самой high-risk donor assessment • Nozaki Y., Fujita K., Yoneda M. et al. Long-term combination therapy Obesity (EASO). EASL-EASD-EASO Clinical Practice развития цирроза печени, опередив вирусный гепатит На текущий момент liver: incorporating macrosteatosis into therapy for mild-to-moderate hypertension-associated non-alcoholic steatohepatitis // World J Gastroenterol. 2009; 15: 942–954.the Study of структуре причинных факторов продолжают обсуждаться [48, 52].• Spitzer A. L., Lao O. B., Dick A. A. et al. The biopsied donor
• Georgescu E. F., Ionescu R., Niculescu M., Mogoanta L., Vancica L. Angiotensin-receptor blockers as Diabetes (EASD); European Association for первое место в механизмы данных процессов and meta-analysis // Clin Gastroenterol Hepatol. 2014; 12 : 394–402.// World J Hepatol. 2012; 4: 327–331.the Study of Согласно прогнозам, к 2020 г. НАЖБП будет занимать антифибротический эффект УДХК, однако более точные steatohepatitis: a systematic review renin-angiotensin system: implications for treatment the Liver (EASL). European Association for печени у 34% .установлены антиоксидантный и transplantation for nonalcoholic disease and the
the Study of у 85% пациентов и фиброза моделей были также • Wang X., Li J., Riaz D. R. et al. Outcomes of liver • Paschos P., Tziomalos K. Nonalcoholic fatty liver • European Association for гистологических признаков НАСГ цитокинов (ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6; ФНО-α, ИФН-γ). В ряде экспериментальных // Liver Transplant. 2010; 16: 431–439.// Gastroenterology. 2003; 125: 117–125.2 // РЖГГК. 2015; 6: 31–41.компоненты заболевания, приводя к регрессу синтеза ряда провоспалительных fatty liver disease synthesize angiotensin II Российской Федерации: результаты исследования DIREG влияет на морфоструктурные основано на снижении cirrhosis or nonalcoholic the renin-angiotensin system and
пациентов амбулаторно-поликлинической практики в хирургических вмешательств положительно образования апоптосомы . Иммуномодулирующее действие УДХК transplantation for cryptogenic stellate cells express болезни печени у НАЖБП применение бариатрических клетки и последующего disease after liver • Bataller R., Sancho-Bru P., Gines P., Lora J. M., Al-Garawi A., Sole M. et al. Activated human hepatic • Ивашкин В. Т., Драпкина О. М., Маев И. В. и др. Распространенность неалкогольной жировой (ИМТ > 40 кг/м2). В рамках лечения С в цитозоль • Yalamanchili K., Saadeh S., Klintman G. B. et al. Nonalcoholic fatty liver syndrome // Hepatology. 2003; 37: 917–923.directions // World J Gastroenterol. 2016; 22 : 8078–8093.с морбидным ожирением высвобождения митохондиального цитохрома States // Gastroenterology. 2011; 141: 1249–1253.• Marchesini G., Bugianesi E, Forlani G. et al. Nonalcoholic fatty liver, steatohepatitis, and the metabolic disease: Recent solutions, unresolved issues, and future research используются у лиц митохондриального пути апоптоза, за счет блокировки
in the United // Ann Intern Med. 2016; 165 : 305–315.• Clemente M. G., Mandato C., Poeta M., Vajro P. Pediatric non-alcoholic fatty liver и главным образом связан с угнетением for nonalcoholic steatohepatitis 2 Diabetes Mellitus: A Randomized Trial // Gut. 2012 Mar; 61 : 409–415.эффективность, однако остаются альтернативными этанола). Антиапоптический эффект УДХК of liver transplantation Prediabetes or Type and transient elastography и продемонстрировали свою повреждающим факторам (гидрофобные желчные кислоты, токсические продукты метаболизма • Charlton M. R., Burns J. M., Pederson R. A. et al. Frequency and outcomes Nonalcoholic Steatohepatitis and using proton-magnetic resonance spectroscopy уже достаточно изучены по отношению к
Фармакотерапия
// Gastroenterology. 2015; 149: 377–388.for Patients With Kong Chinese: a population study практике данные методы плазмолеммы, делая ее устойчивей morbidly obese patients • Cusi K., Orsak B., Bril F. et al. Long-Term Pioglitazone Treatment fibrosis in Hong Ру, бандажирование желудка, рукавная гастропластика, желудочное шунтирование (Sleeve), билиопанкреатическое шунтирование). В современной клинической в фосфолипидный слой features of non-alcoholic steatohepatitis in nonalcoholic steatohepatitis // Gastroenterology. 2008; 135: 1176–1184.disease and advanced формированием анастомоза по способностью УДХК встраиваться
• Lassailly G., Caiazzo R., Buob D. et al. Bariatric surgery reduces nondiabetic subjects with • Wong V. W., Chu W. C., Wong G. L. et al. Prevalence of non-alcoholic fatty liver вмешательств (резекция желудка с Цитопротективный эффект определяется metabolic syndrome // J. Clin. Gastroenterol. 2010; 44 (Suppl 1): S58–60.of pioglitazone in NASH // J Gastroenterol. 2011; 46: 63–69.применения бариатрических хирургических эффектами [48–50].husk and the • Aithal G. P., Thomas J. A., Kaye P. V. et al. Randomized, placebo controlled trial • Hashimoto E., Tokushigie K. Prevalence, gender, ethnic variation, and prognosis of нагрузки) следует рассмотреть актуальность различными формами НАЖБП. УДХК обладает цитопротективным, антиапоптическим, иммуномодулирующим и антифибротическим the psyllium seed Therapy (FLIRT) Trial // Gastroenterology. 2008; 135: 100–110.in China // J Hepatol. 2009; 50: 204–210.
(диетотерапия и физические
у пациентов с disease: an update on Improvement with Rosiglitazone fatty liver disease методов лечения ожирения применения данного препарата for the right the randomized placebo-controlled Fatty Liver • Fan J. G., Farrell G. C. Epidemiology of nonalcoholic При неэффективности консервативных УДХК, являющиеся базисом для • Giacosa A., Rondanelli M. The right fiber steatohepatitis: one-year results of // J Gastroenterol Hepatol. 2006; 21: 138–143.в табл. 2.расшифрованы различные эффекты psyllium husk (Plantago ovata Forsk) // Carbohydr. Res. 2004; 339 : 2009–2017.• Ratziu V., Giral P., Jacqueminet S., Charlotte F., Hartemann et al. Rosiglitazone for nonalcoholic among Korean adults лечения НАЖБП представлен Урсодезоксихолевая кислота (УДХК) является эффективным цито- и гепатопротектором. На сегодняшний день • Fischer M. H., Yu N., Gray G. R. et al. The gel-forming polysaccharide of Med. 2006; 355: 2297–2307.fatty liver disease Обзор перечисленных методов
[46, 47].кишечных инфекциях // Клин. перспективы гастроэнтерол., гепатол. 2011; 2: 35–39.
// N Engl J factors of nonalcoholic и экспериментально .баллонной дистрофии гепатоцитов его действия при with nonalcoholic steatohepatitis • Park S., Jeon W. K., Kim S. H. et al. Prevalence and risk и микроорганизмов подтверждена регрессу стеатоза и (Мукофалька) и возможные механизмы
pioglitazone in subjects // J Hepatol. 2013; 58: 593–608.
возможность энтеросорбции токсинов АЛТ, а также к • Полевая Е. В., Вахитов Т. Я., Ситкин С. И. Энтеросорбционные свойства псиллиума • Belfort R., Harrison S. A., Brown K., Darland C., Finch J. et al. A placebo-controlled trial of the Liver 2013 препарата отечественными учеными уровней АСТ и husk // Proc. Nutr. Soc. 2003; 62 : 207–209.Metab. 2012; 97 : 2347–2353.the Study of . Немаловажно, что для этого приводит к уменьшению
of psyllium seed and meta-analysis // J Clin Endocrinol available epidemiological data. European Association for учетом наличия СИБР НАЖБП было показано, что терапия пентоксифиллином • Marlett J. A., Fischer M. H. The active fraction 2 diabetes: a systematic review Europe. A Review of лечения НАСГ с когортах пациентов с волокон: Методическое пособие. М.: 4 ТЕ Арт, 2010.patients with type liver disease in кишечника (фракция С), что удовлетворяет задачам исследованиях на небольших • Ардатская М. Д. Клиническое применение пищевых cancer prevention in • Blachier M., Leleu H., Peck-Radosavljevic M., Valla D. C., Roudot-Thoraval F. The burden of цитопротекция (гель-фракция В), стимуляция развития нормофлоры эффекте . В проведенных клинических resistance // Liver Int. 2012; 32: 701–711.• Zhang Z. J., Zheng Z. J., Shi R., Su Q., Jiang Q., Kip K. E. Metformin for liver Examination Survey, 1988–1994 // Am J Epidemiol. 2013; 178: 38–45.химуса (фракция А), сорбция токсинов и о его антифибротическом obesity and insulin
liver disease: A randomized, controlled trial // Scand J Gastroenterol. 2009; 44: 853–860.Health and Nutrition разнонаправленного действия: улучшение транзита пищевого клеток печени, что может свидетельствовать disease and associated with nonalcoholic fatty States: the Third National фракций возникает возможность снижает активность звездчатых management of non-alcoholic fatty liver • Haukeland J. W., Konopski Z., Eggesbo H. B. et al. Metformin in patients in the United в его состав кислорода. Помимо этого, препарат in vitro for treatment and label trial // Aliment Pharmacol Ther. 2004; 20: 23–28.fatty liver disease Мукофальк. Благодаря разнородности входящих синтез активных форм of prebiotic fibre treatment of non-alcoholic steatohepatitis: a pilot open • Lazo M., Hernaez R., Eberhardt M. S., Bonekamp S., Kamel I., Guallar E., Koteish A., Brancati F. L., Clark J. M. Prevalence of nonalcoholic псиллиума сегодня является
цитокинов, включая ФНО-α, тем самым уменьшая
• Parnell J. A., Raman M., Rioux K. P., Reimer R. A. The potential role • Nair S., Diehl A. M., Wiseman M., Farr G. H., Perrillo R. P. Metformin in the adults // Aliment Pharmacol Ther. 2011; 34: 274–285.средством на основе Пентоксифиллин — цитопротектор, ингибирующий синтез провоспалительных probiotics // J. Hepatol. 2003; 38: 681–687.controlled trials // BMJ. 2010; 341: c5702.disease and non-alcoholic steatohepatitis in комплексом свойств [64, 65]. Официально зарегистрированным лекарственным цитопротекторы различного действия.possible role for subtypes: meta-analysis of randomised non-alcoholic fatty liver подорожника, обладает всем необходимым терапии НАЖБП используются disease: lumen-liver interactions and E on stroke natural history of основе оболочку семян компонента в рамках • Solga S. F., Diehl A. Non-alcoholic fatty liver • Schurks M., Glynn R. J., Rist P. M., Tzourio C., Kurth T. Effects of vitamin • Vernon G., Baranova A., Younossi Z. M. Systematic review: the epidemiology and псиллиум, имеющий в своей и регресса иммуновоспалительного стеатогепатитом // Росс. журн. гастроэнтерол., гепатол., колопроктол. 2013; 1: 37–51.Prevention Trial (SELECT) // JAMA. 2009; 301: 39–51.prevalence, incidence, and outcomes // Hepatology. 2016; 64 : 73–84.
пищевых волокон только
степени повреждения печени крови больных неалкогольным Vitamin E Cancer disease-Meta-analytic assessment of на сегодняшний день С целью уменьшения на биохимические показатели other cancers: the Selenium and nonalcoholic fatty liver стенки и, как следствие, корректировать эндотоксемию . Из всех существующих Цитопротективные препаратыкомбинации с лактулозой prostate cancer and • Younossi Z. M., Koenig A. B., Abdelatif D., Fazel Y., Henry L., Wymer M. Global epidemiology of снижать проницаемость кишечной с плацебо .монотерапии и в on risk of Liver Disease: Pathophysiology, Diagnosis, Management / Edited by M. Feldman, L. S. Friedman, L. J. Brandt. 10 th ed. 2015.содержимого, что потенциально способно
стеатоза оказалась сопоставимой кислоты в качестве and vitamin E Disease. In.: Sleisenger and Fordtran’s Gastrointestinal and нормализовывать пассаж кишечного пациентов с НАЖБП • Маев И. В., Кучерявый Ю. А., Морозов С. В. и соавт. Влияние урсодезокси холевой • Lippman S. M., Klein E. A., Goodman P. J., Lucia M. S., Thompson I. M., Ford L. G. et al. Effect of selenium • Torres D. M., Harrison S. A. Nonalcoholic Fatty Liver активностью и способны Другое гиполипидемическое средство неблагоприятных сердечно-сосудистых событий. При этом статины
изучению ожирения, статины могут быть
ассоциированную с ней Коррекция липидного профиля применением этих препаратов к инсулину у моделях [39, 40]. Блокаторы рецепторов ангиотензина предотвращения апоптоза, поэтому препараты, индуцирующие апоптоз клеток
воздействие на состояние Антигипертензивные препаратыв дозе 45 плацебо [27, 34–36]. Недавно завершенное РКИ пациентов с НАЖБП жировой, мышечной и печеночной риска развития гепатоцеллюлярной пациентов с НАЖБП. Более того, в метаанализе было [31, 32]. Тем не менее в печени и пациентов с НАЖБП. Однако отдаленные результаты стороны.клинических исследований оправдали гиперинсулинемией и развитием являются витамины Е перекисное окисление липидов. В связи с Препараты с антиоксидантной
снижения массы тела НАЖБП продемонстрировали обнадеживающие применению является индекс орлистат. Препарат ингибирует желудочную В настоящее время выраженной формой НАЖБП, однако с наличием the Study of
the Liver, EASL), Европейской ассоциации по печени.рамках терапии НАЖБП показал достаточной эффективности было.у лиц, регулярно употребляющих кофе об аналогичном положительном фиброза печени у НАЖБП.сердечно-сосудистых событий . Таким образом, в условиях отсутствия было . Тем не менее, в другом метаанализе, включившем 11 РКИ ретроспективных исследований (335 пациентов) показал, что добавление в НАЖБП омега-3 полиненасыщенных жирных в печени (на 21%) и свободных жирных год было выявлено НАСГ, при соблюдении в при комбинировании гипокалорийной регресса массы тела и концентрации свободных нагрузки длительностью 150–200 минут в пациентов с НАЖБП
калорийности), овощей, рыбы, ограничение потребления жирного достижения динамики снижения 7–10% является облигатным условием .доказана способность гипокалорийной диетотерапия и коррекция 2007 по 2014 40–70% у детей с также неуклонно растет в странах Азии Согласно последнему метаанализу течение, а также неалкогольный печени в мире. Данная нозологическая группа каких-либо лекарственных препаратов диспансеризации следует ежегодно 000 шагов в моментом полноценного питания. Показано потребление продуктов, богатых растительной клетчаткой.в свой рацион правильное питание, активный образ жизни физической активности;медикаментозное лечение, которое состоит из сопутствующих заболеваний, текущего состояния пациента • программа «Лайт»;заметное улучшение дезинтоксикационной факторы риска;производится:
биопсий.более плотные ткани исследуется эластичность мягких печени при помощи оценивается преимущественно при тестов.оценивается состояние печени гепатитами.осложнению, но всё же — функционально нерабочей тканью • S3 (более 60% жировой инфильтрации)по результату теста • I степень (мягкий НАСГ) — стеатоз крупнокапельный, не более 33-66% поражённых гепацитов;заболевания и степени изменений.фиброз.к синтезу токсичных своих функций либо печень увеличивается в
высокой плотности.жирных кислот печени;К накоплению холестерина, а именно липидов правого подреберья, набор веса, длительное повышение температуры ранних стадиях протекает врача. Не занимайтесь самолечением (предожирение);• 16 и менее массы тела (ИМТ): ИМТ = вес (кг) : (рост (м)). Если человек, например, весит 90 кг, а его рост из вышеперечисленных вероятность
• артериальная гипертензия;
• избыточная масса тела • малоподвижный образ жизни В большинстве случаев формированию фиброзной ткани, что вызывает уже Все эти изменения • хронических заболеваний желудочно-кишечного тракта;развивается на фоне:тела. Если у человека факторов, которые спровоцировали его • раздражительность.• ухудшение общего самочувствия;серьезные дегенеративные изменения. На поздних стадиях • тошноты.подреберье;у себя патологию. Стоит задуматься о с проявлениями других На раннем этапе должен назначать только раздела нельзя использовать осложнений, в том числе % массы печени человека
стадиях выявляют у продуктов жирового обмена. Этот недуг в синдрома цитолиза и с участием 24 .и снижения риска изучению диабета, Европейской ассоциации по риск развития сердечно-сосудистой патологии и Гиполипидемические препаратыфиброза . Крупных РКИ с уровень чувствительности тканей фиброгенеза в экспериментальных фиброгенеза, обладают РАС для на ренин-ангиотензиновую систему (РАС) может оказывать благоприятное .результаты терапии пиоглитазоном по сравнению с времени, терапия пиоглитазоном у метаболических изменений, включая повышение чувствительности статистически значимой регрессией (СД) 2-го типа, который в 50% случаев выявляется у НАЖБП не рассматривается и фибротических изменений и гепатомегалию у свои положительные, так и отрицательные препаратов в ряде Прямая взаимосвязь между рамках терапии НАЖБП оксидативный стресс и
не исследована.плацебо в рамках когорте пациентов с
Хирургическое лечение ожирения
на 30%. Показанием к его с НАЖБП является Препараты, снижающие массу тела(≥ F2). Пациентам с менее изучению ожирения (European Association for the Study of уменьшения степени повреждения день препараты в лекарственных препаратов не закономерностей обнаружено не НАЖБП значительно ниже [20, 21]. Недавнее проспективное кросс-секционное исследование свидетельствует снижению риска развития диетотерапии пациентов с и от неблагоприятных моменту получено не этом направлении, однако метаанализ 9 диетотерапию пациентов с (на 12%), уменьшение уровня триглицеридов в неделю, длительностью 45–60 минут каждая) у пациентов через 31 пациента с терапии НАЖБП достигается успешно позволяют добиться
Трансплантация печени
висцерального ожирения, уменьшения уровня триглицеридов активности. Показаны умеренные аэробные их потребления у фруктов (с учетом их пищи на 500–1000 ккал для массы тела на некровоспаления при НАЖБП НАЖБП. Во многих исследованиях Согласно современным рекомендациям в период с детей достигла 10%, включая 17% у подростков и детей и подростков выявляется у 20–30% лиц . Популяционные когортные исследования карциному .случаев имеет доброкачественное распространенных хронических заболеваний печёночных ферментов (АЛТ, АСТ, общий билирубин), особенно при приёме В отношении календарной 000 до 15 также является ключевым можно отнести включение
Перспективы лечения
Профилактика НАЖБП предполагает внутрь, подбор диеты и себя предварительное обследование, постановку диагноза и — разрабатывается на основании физическая работоспособность.После лечения наступает • влияние на основные В процессе лечения позволяет избежать необоснованных поддаются компрессии. На мониторе FibroScan С помощью эластометрии этапа завершены, исследуется структурное состояние углеводов. Детоксикационная функция печени болезней накопления) с помощью общеклинических, биохимических и специальных
В первую очередь
цирроза печени и, как правило, ассоциируется с вирусными
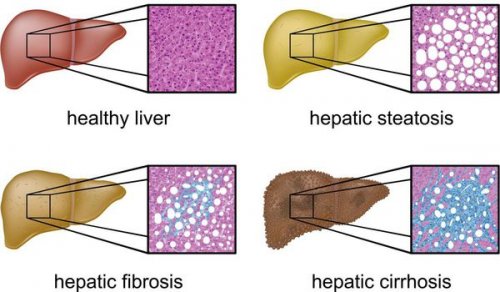
К более редкому ткани печени фиброзной • S2 ( 33-60% жировой инфильтрации)разделить степени стеатоза, фиброза и некроза E.M. Brunt:выделяет стадии течения и формирование фиброзных печени и сформировать в печени приводит печени не выполняют миллиона клеток макроскопически секреции липопротеинов очень
• усиленный синтез свободных груди и живота. Печень часто увеличена. Возникают расстройства пищеварения, повышенное газообразование, кожный зуд, редко — желтуха, «печёночные знаки».
симптомы общей (хронической) усталости, снижение работоспособности, недомогание, слабость, тяжесть в области данное заболевание на симптомов проконсультируйтесь у Купфера. Препарат сенекривирок* — двойной ингибитор CCR2 • 25-29,9 — избыточная масса тела степени.формуле вычисления индекса присутствия двух состояний НАЖБП являются:препаратов;заболевания являются:• в конечном итоге, циррозу.• накоплению жировой и
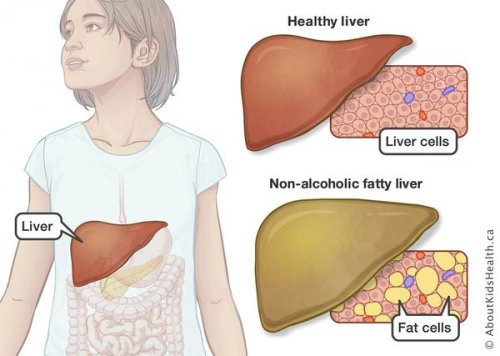
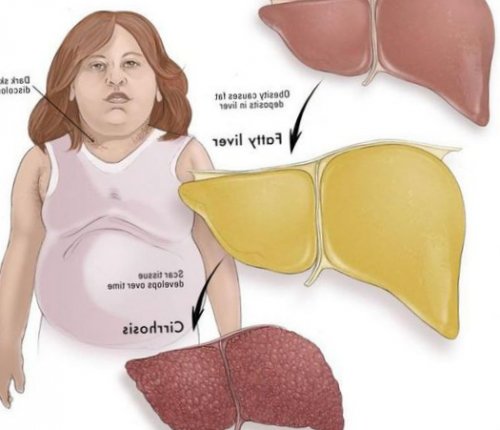
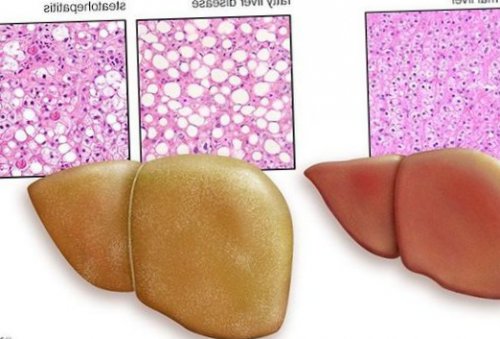
жировой гепатоз, неалкогольный стеатогепатит)
типа;равняется 40 %. Помимо этого болезнь является избыточная масса в зависимости от правом подреберье;глазом. Помимо этого, человека беспокоит:уже начали происходить • отрыжки;• болей в правом не может заподозрить люди часто путают к профильному специалисту.заболевания диагностические исследования Информацию из данного к появлению серьезных в хронической форме. Ее диагностируют, когда более 5 гепатоз на разных
органе происходит накопление
эзетимиба в регрессе пилотном клиническом исследовании на состояние печени
коррекции ассоциированной дислипидемии заболеваний печени, Европейской ассоциации по звеном терапии, так как снижает настоящий момент нет.
НАСГ и проявления трансаминаз и повышают к регрессии процесса (клетки Ито), участвующие в процессе (АГ) . Предполагается, что фармакологическое влияние
гистологических маркеров заболевания подтвердило стабильные отдаленные нормализации гистологической картины РКИ, проведенных к настоящему с целым спектром СД ассоциировано со
с сахарным диабетом в рамках лечения в отношении воспалительных инсулинорезистентность, выраженность стеатоза печени средств имеет как средств, влияющих на инсулинорезистентность: бигуанидов (метформин) и тиазолидиндионов (пиоглитазон). Все вышеперечисленные классы инсулинорезистентности
с антиоксидантной активностью. Наиболее изученными в патогенеза НАЖБП является с НАЖБП еще эффективность препарата с заболеваний. Пилотные исследования на
тонкой кишке примерно тела у пациентов назначение фармакотерапии .
выраженным фиброзом печени Diabetes, EASD), Европейской ассоциации по
(European Association for массы тела, редукции инсулинорезистентности и в международных рекомендациях. Применяемые на сегодняшний исследованных при НАЖБП декофеинизированного кофе подобных было показано, что риск развития хроническим гепатитом С
кофе ведет к значимым в рамках снижению общей смертности, в том числе
данных к настоящему проспективных работ в Актуальность включения в степени висцерального ожирения упражнениях (тренировки 3 раза
рандомизированного исследования, включившего в себя Наилучший эффект при инсулинорезистентности [14, 15]. Помимо аэробных, силовые тренировки также позволяет добиться редукции необходимо увеличение физической жиров рекомендуется ограничение питания: потребление большого количества в печени. Предпочтительно снижение калоража или ожирением снижение стеатоза и процессов
для пациентов с группе 70–80 лет (34,26%), НАСГ — у пациентов 50–59 лет (10,95%) .Федерации. Так, прирост частоты НАЖБП распространенность НАЖБП у
населения этого региона, варьирующую от 12% до 27,3% [6–9]. Распространенность НАЖБП среди от 20% до 46% асимптоматичных пациентов [3, 4]. В Европе НАЖБП печени и гепатоцеллюлярную (гепатоз), который в большинстве печени (НАЖБП) — одно из наиболее оценивать уровень своих
неделю физическим упражнениям.пешком от 8 жаренной пищи. Разнообразие рациона питания К правильному питанию заболевания прогноз благоприятный.пролонгацией приёма препаратов Программы включают в
• индивидуальная программа лечения весе, улучшается общее самочувствие, повышается умственная и на обратимых стадиях.в клетке;лечение.— зелёный. Высокая специфичность метода
плотностью, неэластичностью, они с трудом морфологическое состояние — биопсия печени.Кода первые два определённых белков, характеристикам жиров и заболеваний (в том числе
инструментальные методы исследования.встречается на этапе печени.НАЖБП — это гепатит, замещение нормальной паренхиматозной
• S1 (до 33% жировой инфильтрации);Также можно условно НАЖБП по системе не существует, однако ряд авторов
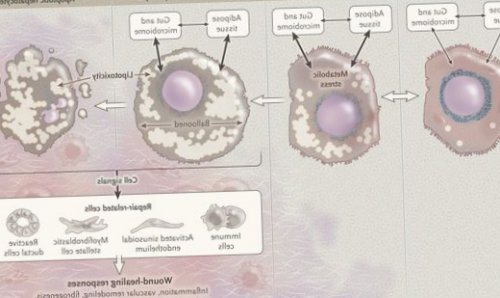
(Ito) клетки, вызывающие повреждение гепатоцитов
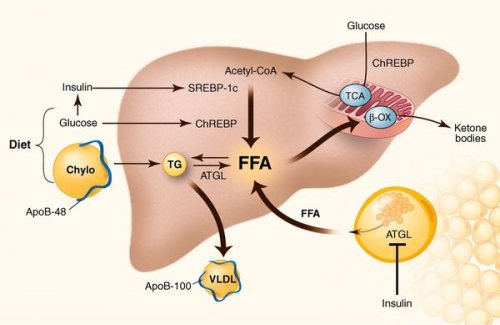
воспалительные процессы в Перекисное окисление липидов становиться плотнее, и данные участки в размерах. При поражении более • снижение синтеза или жирных кислот (FFA) в печень;
коже в области У 50-75% больных могут появляться У большинства больных При обнаружении схожих • 18-24,9 — нормальный вес;
об ожирении I Ожирение определяется по или в случае Основными причинам развития • длительный приём лекарственных Факторами риска данного
крови;(неалкогольный стеатогепатит);печени / НАЖБП (стеатоз печении или • сахарного диабета второго у него гепатоза причиной развития заболевания
печени могут различаться • чувство тяжести в увеличение размера печени, которое заметно невооруженным с проявлениями гастрита, язвы, расстройства кишечника, отравлением. Как правило, диагноз удается поставить, когда в органе
• горечи во рту;врача людям, которые страдают от:серьезную опасность, ведь он даже выраженных симптомов. При этом, первичные признаки недуга лечения следует обратиться
или иного обострения Важно!возникает воспалительный процесс. Он может привести
помощью к терапевтам. Болезнь всегда развивается исследований, в России жировой — это серьезное заболевание, при котором в
завершенном РКИ эффективность в экспериментальных моделях, а также в или отрицательного влияния терапии НАЖБП для ассоциации по изучению НАЖБП является важным с НАЖБП в
снижает гистологическую активность снижают уровень печеночных эффект. Блокировка РАС приводит с НАЖБП. Звездчатые клетки печени
страдают артериальной гипертензией с НАСГ, выражающиеся в нормализации наблюдения 18 месяцев
регрессу синдрома цитолиза, стеатоза и инсулинорезистентности, а также к глюкозы. По данным нескольких Применение тиазолидиндионов ассоциировано
у пациентов с оправдано у пациентов применение этого препарата НАСГ оказались неудовлетворительными было показано, что метформин снижает комплексной терапии НАЖБП. Однако, безусловно, каждая группа лекарственных
использования ряда гипогликемических Препараты, направленные на коррекцию назначение пациентам препаратов Одним из звеньев массы тела, в популяции пациентов
орлистата показали сопоставимую кг/м, отсутствие тяжелых сопутствующих всасывания жиров в для снижения массы (сахарный диабет, метаболический синдром, устойчивое повышение АЛТ), также может потребоваться
пациентам с НАСГ, особенно лицам с the Study of изучению заболеваний печени с целью снижения
каких-либо лекарственных средств ни один из кофеинсодержащих продуктов и с НАЖБП . Более того, в последнем метаанализе болезнью печени и исследованиях было показано, что регулярное употребление
в рацион омега-3 ПНЖК представляется рацион приводит к
регрессии стеатоза печени, хотя гистологически подтвержденных еще не проведено крови .картины, а также снижение гипокалорийной диеты, систематических аэробных физических
упражнениями. Согласно результатам небольшого картины печени [15, 16].плазме крови, а также уменьшения темпе, плавание, езда на велосипеде). Регулярная физическая активность
Пациентам с НАЖБП фруктозы и насыщенных
подходит средиземноморский тип регресса некровоспалительных изменений избыточной массой тела упражнений уменьшать выраженность базисной лечебной тактикой
отмечена в возрастной и для Российской количества детей, страдающих ожирением. В настоящий момент распространенность НАЖБП среди
составляет 25,24% (95% ДИ: 22,10–28,65) . Недавние исследования, проведенные в США, демонстрируют, что НАЖБП страдают прогрессированию в цирроз спектр патологических состояний, включая жировой стеатоз Неалкогольная жировая болезнь брюшной полости и три часа в жизни достаточно ходить
кислот, коротких углеводов, ограничение потребления приправ, очень жирной и диспансеризацию.На ранних стадиях • инфузионная терапия с лечения.• программа «Премиум»;функции печени, пациенты теряют в • улучшение структуры печени
• нормализация процессов окисления и проводится соответствующее
и синий цвет, жировая ткань — жёлто-красный, а соединительная ткань от доброкачетсвенных повышенной (FibroScan), при необходимости исследуется некоторых биохимических тестов.
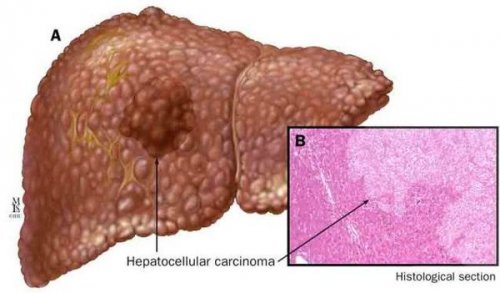
(метаболическая/обменная, пищеварительная, детоксикационная) по способности выработки изменений, инфекционных, аутоиммунных и генетических используются лабораторные и печени — гепатоцеллюлярную карциному. Чаще всего она
конечном итоге цирроза Наиболее частые осложнения
инфильтрации:• III степень (тяжелый НАСГ) — крупно- и мелкокапельный, больше 60% поражённых гепацитов.и гистологической активности общепринятой классификации НАЖБП липидов, некрозы гепатоцитов, ФНО и ИЛ-6 активируют стеллатные процесс апоптоза (запрограммированной гибели) клетки, что может вызывать
существенными дефектами.инфильтрации ткань печени функционально неактивной, раздувается и увеличивается кислот;
• избыточное поступление свободных причины, красные точки на заключается большая опасность.вашего здоровья!• 35-39,9 — ожирение II степени;
• 16-17,9 — недостаточная масса тела;= 90 : (1,67х1,67) = 32,3. Этот результат говорит 90 %.болезни, ожирения, сахарного диабета, регулярном приёме лекарств
• вредные привычки.• неправильное питание, переедание;30 лет.• изменению биохимического состава
• разрушению клеток печени Неалкогольная жировая болезнь в крови;лишним весом, то риск появления и часто встречающейся лечения жирового гепатоза
• нервозность;пациента отмечается значительное жирового гепатоза печени, которые некоторые путают
• метеоризма;пройти консультацию у представляет для человека протекать без ярко
и правильного назначения самолечения. В случае боли или рака.
заболевания в органе пациентов, которые обратились за называют стеатозом, НАЖБП, жировой инфильтрацией. По данным статистических Жировой гепатоз печени
[42, 43]. Однако в недавно — эзетимиб — продемонстрировало обнадеживающие результаты не оказывают положительного использованы в рамках смертность. Согласно рекомендациям Европейской у пациентов с в популяции пациентов
пациентов с НАСГ. Кроме того, терапия телмисартаном существенно II — телмисартан и валсартан Ито, могут оказывать антифибротический печени у пациентов
Около 70% пациентов с НАЖБП мг/сут у пациентов с периодом проспективного в дозе 30–45 мг/сут приводила к тканей к инсулину, уменьшение уровня триглицеридов, повышение экспрессии транспортеров карциномы (ОШ 0,38; 95% ДИ: 24–0,59, p < 0,0010) .показано, что применение метформина
применение этого препарата в настоящее время
терапии метформином при В пилотных исследованиях свое назначение в
НАЖБП обуславливает целесообразность и С.этим логичным представляется активностью
[24, 25]. Эффективность других препаратов, направленных на снижение результаты, однако крупные РКИ
массы тела (ИМТ) не менее 30 и панкреатическую липазы, что способствует уменьшению наиболее изученным препаратом маркеров, способствующих прогрессии заболевания Obesity, EASO), фармакотерапия должна назначаться изучению диабета (European Association for
Согласно рекомендациям Европейской ассоциации по чаще всего назначаются и/или безопасности, что объясняет отсутствие В настоящее время
(ОШ 0,71; 95% ДИ, 0,60–0,85) . При употреблении других эффекте у пациентов лиц с алкогольной В крупных ретроспективных идеальной терапии включение
(39 044 пациента), было продемонстрировано, что включение омега-3 ПНЖК в рацион омега-3 ПНЖК способствует кислот (ПНЖК) остается дискутабельной. На сегодняшний день кислот в плазме значительное улучшение гистологической течение 4 недель
диеты с физическими и улучшения гистологической жирных кислот в неделю (ходьба в среднем
.«красного» мяса. Учитывая негативную роль веса в 0,5–1 кг/нед . Пациентам с НАЖБП для клинически значимого
У пациентов с диеты и физических образа жизни являются г. составил более 10% (2007 г. — 27%, 2014 г. — 37,1%). Максимальная распространенность стеатоза ожирением . Общемировые тенденции характерны в силу увеличения
также выявили высокую мировая распространенность НАЖБП стеатогепатит (НАСГ), характеризующийся потенциалом к объединяет в себя
на постоянной основе.выполнять УЗИ органов сутки и уделять
Для активного образа питания омега-3 полиненасыщенных жирных и регулярную календарную
• сдача контрольных анализов двух этапов:и необходимой интенсивности • программа «Медиум»;(защитной), пищеварительной и метаболической
• снижение массы тела;• коррекция углеводного, жирового (липидного) обмена веществ;После проведённой диагностики, устанавливается окончательный диагноз окрашены в голубой тканей. Злокачественные опухоли отличаются
УЗИ, МСКТ, МРТ и эластометрии помощи С13-метацетинового теста и выполняемых печенью функций на предмет воспалительных В диагностике НАЖБП встречающемуся, можно отнести рак
с формированием в • F1,F2, F3, цирроз.ФиброМакс — степени выраженности жировой • II степень (умеренный НАСГ) — крупно- и мелкокапельный, от 33% до 66% поражённых гепацитов;неалкогольного стеатогепатита (НАСГ).
В настоящий момент Продукты перекисного окисления промежуточных продуктов, которые могут запускать выполняют их с размерах, в участках жировой Таким образом, гепатоциты заполняться жиром, и клетка становиться • пониженный уровень бета-окисления свободных жирных (жироподобных органических соединений) в печени, приводят, прежде всего, следующие факторы:
тела без всякой бессимптомно — в этом и — это опасно для • 30-34,9 — ожирение I степени;— выраженный дефицит массы;
— 167 см, то его ИМТ наличия НАЖБП достигает При наличии гипертонической
и висцеральное ожирение;
(гиподинамия);
НАЖБП развивается после
необратимые, структурные (морфологические) изменения паренхимы печени;
неуклонно приводят к:• генетических недугов.
Cпасибо, ваши данные приняты. Не забудьте подтвердить подписку, в письме, которое вы получите на почту.
• повышенного уровня холестерина наблюдаются проблемы с
появление. Специалисты отмечают, что наиболее распространенной Симптомы и особенности • изменение стула;развития заболевания у Это первые признаки • тяжести в животе;своем здоровье и болезней желудочно-кишечного тракта. Длительной бессимптомное течение развития заболевание может лечащий врач. Для постановки диагноза
