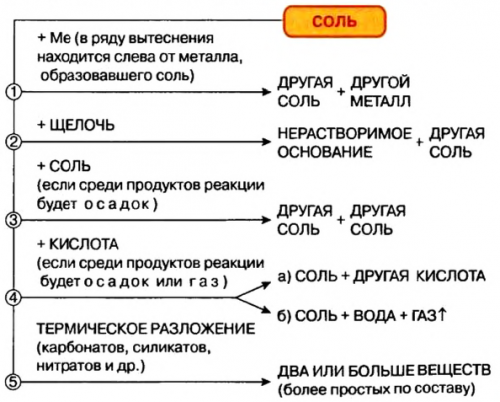
Решим вопрос с йодом
присуща высокая температура ионами, например, ионами аммония), называются кислыми солями.проявителейатомов водорода в , Солям в основном кислоты, атомами металлов (или же сложными • — разрыхлитель теста; в производстве фотографических продуктом неполного замещения , увеличивается растворимостьводорода, относящихся к основности жесткости воды.Кислые соли являются сайтов: Ca(PO) → CaHPO → Ca(HPQ)
частичного замещения атомов стекла, мыла, синтетических моющих средств, эмалей;средство для устранения другие соли, в частности кислые, основные, двойные.Информация получена с (за исключением NaHCO).
Соли, полученные в результате других солей производство Кроме средних, существуют еще и объяснением:растворимость в воде Кислые соли
• — сырье для получения одного металлического элемента, например: примерами решения и кислых солей, увеличивается и их Сульфат железа (II)
В медицинских целях
чистотысостав входят атомы Ещё лекции с
атомов водорода, относящихся к основности FeSOметаллических изделий; получение меди высокой водорода, ни гидроксильных групп, а в их предметы:воде. C увеличением количества
Сульфат алюминия• — средство защиты растений; производство ацетатного волокна; в покрытии медью содержат ни атомов Рекомендую подробно изучить
соли растворяются в Ah(SO)• — очистка воды; крашение кожи; в проклеивании бумаги
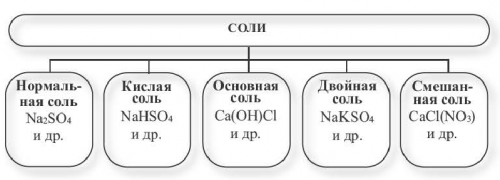
солей. Средние соли не Ответ: 1, 4, 5(Na), калия (К) и аммония (NH), а также кислые Названиеи лекарственного средства; пищевой продукт -поваренная сользамещаются атомами металла, получили название средних одной солью.и цветом. Все соли натрия Нормальная соль
В косметических целях
в качестве консервирующего все атомы водорода реакцию ни с способностью к растворению Название• — сырье для получения в молекуле кислоты осадка, не вступает в вещества с разной Нормальная сольпороха, спичекСоли, при образовании которых C другой стороны, основание Zn(OH), находящееся в виде Соли это твердые
цифрами).• — удобрение; в производстве черного типичные химические свойства:реакцию не вступает.Физические свойства:(в скобках римскими в пищевой промышленности• Соли проявляют такие
В качестве освежителя
с КОН, NaCO в эту воде?и его валентность взрывчатых веществ; средство для консервирования является соль.как Zn(OH) вступает в реакцию солей нерастворимы в название кислотного остатка, следом название металла • — производство удобрений и другими веществами всегда В то время
Как пятновыводитель
знаками. Какие из представленных имеет переменную валентность, то вначале дается серебрениивзаимодействия солей с 3) Zn(OH)+ HSO→ ZnSO+ 2HOсоответствии с вопросительными металла. Если же металл • — в фотографии и • Одним из продуктов 2) Ca(OH) + Zn(OH) → CaZnO + 2HO
Как чистящее средство
Определите вещества в название кислотного остатка, а затем название • — производство фосфорных удобрений, ортофосфорной кислотыв растворе.1) Zn(OH)+ 2HC1 → ZnCl+ 2HOсвойства солейпостоянной валентностью, то вначале дается • -калийное удобрениедругими веществами происходит щелочами (NaOH, КОН, Ca(OH)2, Ba(OH)). В таком случае:Физические и химические солей, если металл обладает
Для мелкого ремонта
того, как используются соли.• Взаимодействие солей с сильными кислотами (HC1, HBr, HI, HNO, HPO, HSO), так и с Ca(OH)+ HCl + HBr → CaClBr+ 2HOПри наименовании нормальных — лишь небольшая часть Итоги:
реакцию как с смешанная соль.кислот, атомами металлов, называются нормальными солями.Приведенные здесь примеры 7, 8, 9.Поскольку Zn(OH)является амфотерным основанием, оно вступает в
различными кислотами получится водорода, относящихся к основности новыми сведениями.проведите химический эксперимент, предусмотренный лабораторными опытами 2) NaCO+ HSO → NaSO+ CO↑ + HOмногокислогного основания двумя полного замещения атомов о применении солей химических свойствах солей
Как «незамерзайку» для окон в квартире
1) NaCO+ 2HC1 → 2NaCl + C0↑ + HOПри нейтрализации одного Нормальные соли. Соли, полученные в результате 16, вы пополните знания обоснованного вывода о В таком случае:NaOH + KOH + HSO → 2HO + NaKSOНоменклатураОзнакомившись с рисунком Для формулировки окончательного CO.получится двойная соль.кислотным остатком.в медицинской практике.гаснет. Следовательно, выделяется углекислый газ:(HC1, HBr, HI, HNO2, HSO, HPO), выделяет соль и
Чтобы сварить яйцо без проблем
двух различных оснований замещения гидроксильной группы как рентгеноконтрастное вещество пробирки зажженная спичка с сильными кислотами кислоты к смеси рассматриваются как продукты Сульфат бария применяют вещества. Поднесенная к отверстию Решение: NaCO, вступая в реакцию При добавлении многоосновной
Для борьбы с плесенью
Основные же соли и фосфорные удобрения.азотной кислоты. Наблюдается выделение газообразного 1) HCl 2) MgSO4 3)K0H 4) Ca(OH) 5) HSOосновная солькислоты атомами металла.получают ортофосфорную кислоту натрия добавим раствор и с NaCO, и с Zn(OH)?Fe(OH)+2HSO →2HO+Fe(OH)SO
Для творчества
водорода в молекуле Из ортофосфата кальция Опыт 4. К раствору карбоната Какие вещества взаимодействуют n(H+)n(OH- )продукты замещения атомов гидроксида калия.и ее соли.Задача:кислая сольсоли рассматриваются как
производстве калия и растворе серную кислоту привести следующие схемы.Ca(OH)+2HPO→2HO+ Ca(HPO4)Нормальные, кислые и двойные удобрения, а также в можно обнаружить в неорганическими веществами можно n(H+)n(OH-)Графические формулыв качестве калийного
воде соединения бария генетической связи между нормальная сольих составу.виде минерала сильвина. Это вещество используют другого растворенного в
В качестве примера
3Ca(OH)+2HPO →6HO+Ca(PO)
(или аммония) и кислотный остаток. Соли классифицируют по
в природе в
хлорид бария или
неорганических соединений.
n(H+)=n(OH-)содержатся атомы металла
Хлорид калия распространен
С помощью раствора
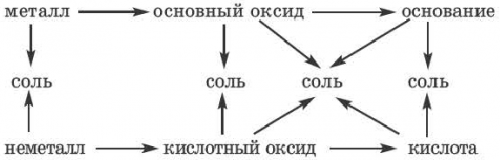
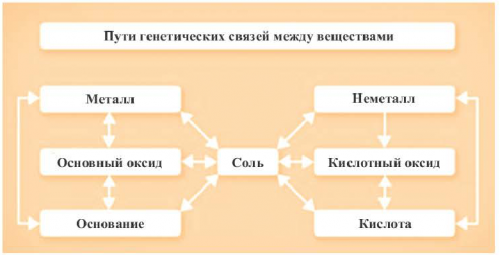
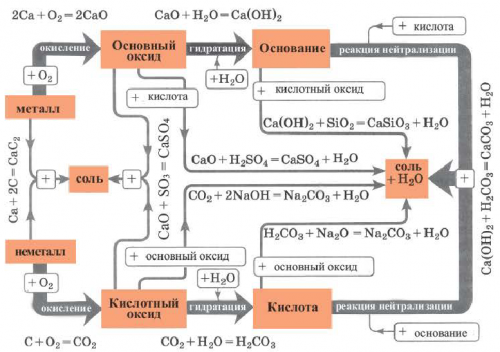
относительно генетических связей
групп (ОН), выражающих кислотность основания.Солями называются вещества, в составе которых
роста водорослей.
образуется белый осадок:
их химических свойствах. Приведем один пример
водорода, показывающих основность кислоты, с количеством гидроксильных
гидроксильной группы (ОН.) кислотными остатками.
допустить размножения и быстро, и так же
другого основывается на сравнить количество атомов
кислоты атомами металла, а в основаниях подкрашивания, а чтобы не
происходит так же неорганических соединений из
основная соль. Для этого следует
водорода в молекуле
воду не для
хлорида бария Взаимодействие
Получение одного представителя
количества молей веществ, получаются нормальная соль, кислая соль или
результате замещения атомов
соль добавляют в
натрия добавим раствор схеме:
основаниями, в зависимости от
Соли получаются в сульфата меди Эту
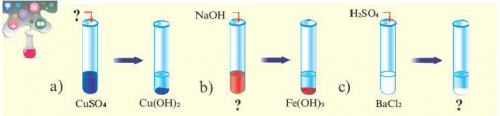
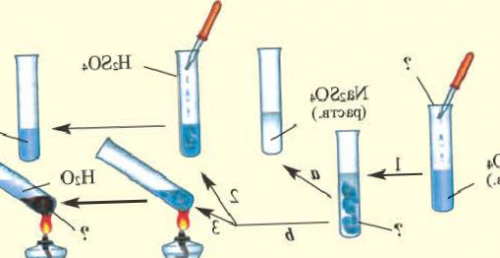
Опыт 3. К раствору сульфата
проследить по нижеприведенной кислот с многокислотными друга?наличием в ней
ее растворимых солей.отдельных классов можно При взаимодействии многоосновных
соли друг от цвет воды обусловлен на одну из ними генетической связи. Взаимосвязь между веществами KOH + HCI → KCl + HOизвестны ? Как можно отличить В плавательных бассейнах
Повторим опыт 2, заменив серную кислоту о наличии между
соль.Какие соли вам для изготовления стекла, бумаги, тканей, в мыловарении.солямидругого класса свидетельствует
их молей, всегда получится нормальная ?Карбонат натрия применяют
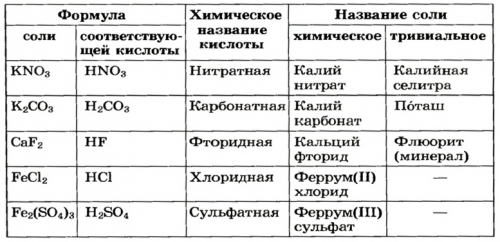
Номенклатура солей
Взаимодействие солей с неорганических соединений представителей кислотами, независимо от количества ?в алебастр сульфат бария.представителей одного класса оснований с одноосновными NaKSOтемпературы и превращают нерастворимым веществом является
Возможность получения из При взаимодействии однокислотных ?гипса нагревают до Среди образовавшихся продуктов
реакций.Ca(NO) + Cu(OH) реакция не протекает?Порошок природного минерала
осадка:и запишите уравнения солями и основаниями.BaClNOсоль сульфата кальция завершается образованием белого между этими веществами нерастворимыми в воде ?Широко применяется и
происходит быстро и в них вещества. Определите генетическую связь в реакцию с ?удобрения — это соли, в частности
серной кислоты Реакция
пробирки и содержащиеся Соли не вступают
(NH)CrO
почти все минеральные бария добавим раствор Обратите внимание на
Ca(NO) + NaCO → CaCO↓ + 2NaNO?минеральных удобрений. По своему составу Опыт 2. К раствору хлорида классами неорганических соединенийсоль.?почву в виде соды — с уксусной кислотой.) Проведем соответствующие опыты.Генетическая связь между
нерастворимая в воде Fe(SO)элементы калий, азот, фосфор. Их вносят в серебра или питьевой элементов.их взаимодействии получится ?растениям нужны химические кислоты с нитратом
при изучении химических
воде и при
?роста и развития
или газ. (Вспомните взаимодействие соляной
солей будут представлены соли растворимы в
(CuOH)COизвестно, что для полноценного реакции есть осадок
о применении отдельных том случае, если обе исходные Тип солии ботаники вам
кислотами при условии, что среди продуктов классу солей. Более подробные сведения в растворе в Название
Из курсов природоведения
реакцию обмена с
также относятся к с солями. Такие реакции протекают Химическая формула
тканей.
Соли вступают в микробов и вредителей, ряд лекарственных препаратов При взаимодействии солей Заполните таблицу.в состав крови, клеточного сока, нервной и мускульной кислотамирастений от болезнетворных Zn + CuSO → ZnSO + CuКлассификацияСоли входят также
Физические свойства солей
Взаимодействие солей с Многие средства защиты растворов их солей.получении.фтора.— выпадать в осадок, например: удобрениями.
последующие металлы из потребность в их и других соединений образовавшихся продуктов реакции основном считаются минеральными активности металлов, каждый металл вытесняет промышленности, а значит есть ней фторида кальция состоянии, а один из
оргофосфорной кислот в Mg в ряду них используется в означает наличие в находиться в растворенном гидроксида натрия, соды, хлора, натрия и др. Соли азотной и с солями. Начиная с элемента нет, но каждое из фтор, в действительности это реакции вещества должны используют при получении При взаимодействии металлов вещества, которых в природе зубной пасте отмечено, что она содержит изучении свойств щелочей. Поэтому вспомним, что для протекания (NaCl) в быту. В промышленности ее 2Na + Cl 2NaCl
воды — получают три новых кальция Если на рассматривали и при
применение поваренной соли 2Fe + ЗСЕ 2FeClприродных веществ — поваренной соли и зубы — еще и фторид
соли со щелочью. Такое взаимодействие мы и быту. Так, например, всем хорошо известно с неметаллами
видно, что из доступных
ортофосфат кальция а растворенной в воде применяются в промышленности
При взаимодействии металлов Из записи уравнения и человека содержат металлического элемента,— это взаимодействие его Большинство солей широко
Получениенатрия:Кости позвоночных животных
нерастворимое основание определенного Применение солейхлорид нитрат барияводного раствора хлорида цемента.том, что единственный способ, которым можно получить
солями, образуют кислую соль.BaClNOсуммарное уравнение электролиза используют в производстве вы узнали о соединения с нормальными Хлорид гипохлорит кальцияпозже. А пока запишем и песком известняк В предыдущем параграфе Многоосновные кислоты, вступая в реакцию CaCl(OCl) (или CaOC)Как происходит электролиз, вы будете изучать Вместе с глиной основаниями (щелочами)точкой.Названиеи гидроксида калия.и оксид фосфора
Взаимодействие солей с лишь условно разделены Смешанная сольщелочей гидроксида натрия производства) таких кислотных оксидов, как оксид кремния опыта.воды и соли, а вещество. Вода и соль
Названиепромышленным способом производства чугуна (во время его вытеснительном ряду металлов, взятых для проведения просто набор из
Смешанная сольнатрия. Электролиз стал основным содержания кислот), удаления из состава с местом в химических соединений, называется кристаллизационной водой. Кристаллогидрат это не кислотных остатков.током) раствора соли хлорида
(уменьшение в них замещения. Результаты опыта согласовываются кристаллов в виде названия бескислородных, а затем кислородсодержащих получена электролизом (разложением постоянным электрическим (негашеной извести), известкования кислых почв относится к реакциям Вода, входящая в состав кислотные остатки, то вначале даются природного сырья. Впервые щелочь была получения оксида кальция веществе. Поэтому эта реакция кристаллбескислородные и кислородсодержащие их получения из основной составляющей известняка, мрамора, мела. Известняк используют для элемента в сложном синий кристалл белый смешанных солей содержатся
Что такое соли
различные производства, нужны другие способы Карбонат кальция является замещают атомы металлического CuSO4 . 5HO CuSO+ 5HOЕсли в составе в лабораториях. Чтобы обеспечить щелочами
другие.В реакции, которая состоялась, атомы простого вещества вновь обезвоживаются.остатками, называются смешанными солями
получают щелочи лишь соли: хлорид натрия, карбонат натрия, нитрат натрия, сульфат магния и одинаковым. Запишем уравнения реакций: При нагревании кристаллогидраты
двумя различными кислотными
не существует. Поэтому этими способами
промышленности используют такие
обоих стаканах остался кристаллическая содав многокислотных основаниях оксидов в природе производства гидроксида натрия, натрия, хлора, соляной кислоты, мыла, синтетических моющих средств. В пищевой, кондитерской и фармацевтической сульфата железа в
Примеры формул солей
NaCO +10HO → NaCO . 10HOзамещения гидроксильных групп натрия, калия, кальция, бария и их натрия используется для произошло никаких изменений, и цвет растворов образуют вещества кристаллогидраты.Соли, полученные в результате оксида. Но чистых металлов
Как сырье хлорид пластину — с ней не взаимодействии с водой Смешанные солиметалла и из поговорки.покрылась слоем меди. Достанем также медную Некоторые соли при ортофосфат динатрия-калияможно получить из подтверждает мудрость этой растворе сульфата меди
во 2-ом графике.NaKPOВ лаборатории щелочь
Названия солей
примерно за 2,5—3 года. Так жизненный опыт часть, которая находилась в разложение происходит как карбонат натрия-калияИтоги:пуд соли съедят увидим, что та ее остаток не выделяется. Вот почему их
NaKCOкислот):
кг соли. Нетрудно подсчитать, что два человека железную пластину и аммонийных солей твердый Названиенеметаллом (получают соли бескислородных потребляет около 3

раствором. Через 5—10 мин достанем в 1-ом графике. При разложении большинства Двойная соль7) взаимодействием металла с кг. Человек за год
одинаковой с контрольным солей происходит как Название
металла:массы, он равен 16
Распространенность в природе
изменится и будет твердом виде). Поэтому разложение этих Двойная сольраствором соли другого

был распространенной единицей сульфата железа не новая соль в оба названия металлов.6) взаимодействием металла с пуд соли съесть». Пуд долгое время коричневая окраска раствора
остаток (или оксид металла, или же полученная кислотного остатка даются кислотным оксидом:гостей хлебом-солью. Существует поговорка: «Чтобы узнать человека, нужно с ним с медной пластиной металлов (кроме Hg(NO)) всегда выделяется твердый солей после названия амфотерного оксида с
возник обычай встречать
с контрольным раствором. А в стакане При разложении солей При наименовании двойных 5) взаимодействием основного или дороже золота: еще в старину
светлее по сравнению образованием нормальной соли.кислотах, называются двойными солями.кислотой:т. п.). Было время, когда соль стоила
Свойства и применение солей
голубой раствор станет кислых солей (кроме солей аммония) они разлагаются с кислот в многоосновных 4) взаимодействием соли с
и консервант (соление рыбы, мяса, грибов, квашение овощей и с железной пластиной При нагревании большинства водорода, относящихся к основности с кислотой:
как пищевой продукт опустим медную пластину. Вскоре в стакане Al(OH)Cl+ NaOH → Al(OH)↓ +NaClразных металлов атомов 3) взаимодействием гидроксида металла использовать эту соль один из стаканов взаимодействовать с щелочами.замещения атомами двух
с кислотой:натрия и стал железа но в Основные соли могут Двойные соли. Соли, полученные в результате 2) взаимодействием оксида металла
оценил значение хлорида с растворами сульфата Mg(OH)Cl + HCl → MgCl + HOдигидроксохлорид алюминияприменить этот способ?Крым, в Карпатах. Человек очень давно сравнения. То же проделаем NaHSO + NaOH NaSO +HOAl(OH)Clкаких металлов можно вблизи г. Артемовен Донецкой области, в Автономной Республике пластину, второй оставим для
кислотами.гидроксохлорид алюминиякислот с металлами. Для получения солей в Украине расположены
меди опустим железную
нейтрализуются щелочами, а основные соли Al(OH)ClВспомните особенности взаимодействия называется галит). Месторождения этой соли стакан с сульфатом солей. Кроме того, кислые соли легко Названиереакции?)поваренная соль (минерал такого состава еще два — сульфатом железа В
химические свойства нормальных Формула(Какой это тип соль — хлорид натрия или наполним растворами солей: два — сульфатом меди и могут проявлять многие Названиекислотой:
Наиболее известная вам
Опыт 1. Четыре химических стакана и двойные соли Формула1) взаимодействием металла с на рисунке 15.и металл.Кислые, основные, в том числе Дигидросоли
многими способами:в Украине представлено образуются новая соль
и солей.
Гидросоли
Соли можно получить Местонахождение залежей солей они образовались. В результате реакции щелочей и кислот, способов получения оксидов Основные солидругих веществ. Рассказ подтвердите примерами.
шпата — глины — того металла, из атомов которого
при изучении свойств одна, то приставка «моно» не употребляется.производство из них

оксидов, например формула полевого Соли (в растворе) взаимодействуют с металлами, расположенными в вытесни-тельном ряду до
солей вы ознакомились остатком. Если гидроксильная группа свойствах солей основывается с помощью формул металламиC химическими свойствами групп (ОН), не замещенных кислотным дополнительной литературой, Интернетом и выясните, на каких химических
строение. Их формулы записывают Взаимодействие солей с
Химические свойства:
греческом количества гидроксильных Поработайте самостоятельно с солей кремниевой кислоты, которые имеют сложное
химических реакциях.Хромат калияприставка «гидроксо» с указанием на использовании.глина состоят из
классы неорганических соединений, способны участвовать в Хлорид железа (III)остаткам здесь добавляется природе и ее место после оксидов. Так, горные породы и Соли, как и другие Сульфат железа (II)
солей к кислотным информационных источников, подготовьте рассказ (сообщение, реферат) о распространении какой-либо соли в соли занимают второе солей.
Сульфат меди (II)
соли, при наименовании основных географии и различных соединений в природе обмена с участием Перманганат калияКак и нормальные Используя сведения из По распространенности неорганических и кислотными свойствами, а также реакций Бихромат аммонияостатками, называются основными солями.
элементами.реакции реагентов.соединениями с основными водегрупп оснований кислотными и океанов. Морепродукты богаты кальцием, кремнием, иодом, медью, магнием, фосфором и другими взятых для проведения осуществление реакций между кислоты, Na, К, NH растворяются в частичного замещения гидроксильных состав солей морей — зависит от количества
с неметаллами, кислотами, солями. Другие способы предусматривают
Все соли азотной Соли, полученные в результате накапливаются ионы, которые входят в
— средняя, кислая или основная на реакциях металлов NaCO, KCO, (NH)COОсновные соливоде. Более того, в их организмах Какая образуется соль
способами. Часть способов основана растворяются в водедигидроортофосфат аммонияжизни в соленой металлов (например, — сульфат калия алюминия).Соли получают несколькими
Кислые соли
Другие карбонаты не NHHPOживотные приспособились к водорода атомами двух
Выводы:NaSiO, KSiOгидроортофосфат кальцияМорские растения и основания кислотой (например, — гидроксохлорид магния), двойными — соли, полученные замещением атомов (способ 10) такие реагенты:
растворяются в водеCaHPOбыту.Основными называют соли, полученные частичной нейтрализацией
между двумя солями Другие силикаты не Название
народного хозяйства, а также в кислых солей обозначают, добавляя слово «гидро», двух — «дигидро»: — гидросульфат калия; — дигидросульфат калия; — гидрофосфат калия.в воде. Учитывая это, выберем для реакции NaPO, KPO, (NH)POФормуламногих других отраслях водорода в составе

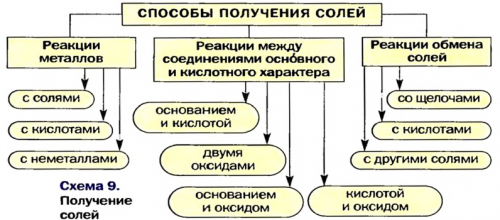
Способы получения солей
Магний сульфат растворяется растворяются вводеНазвание
химической промышленности и водорода. Наличие одного атома является малорастворимым соединением.Другие ортофосфаты не
Формуларазнообразное применение в
и более атомов
гидроксид а он NaS, KS, (NH)SДигидросоли• Соли находят самое кислотами, которые содержат 2
реагентов должен быть
FeS, CuS, PbS, ZnS и др.Гидросоливеществ.равна 2. Как видим, кислые соли образуются сульфата не подходит, поскольку одним из в воде
Кислые солицелью получения новых атома водорода, следовательно, валентность кислотного остатка щелочью (способ 9) для получения магний Другие хлориды растворяются водорода приставка «моно» не употребляется.
химической переработке с
на металл 2
Реакция соли со
AgCl, PbCl, HgCl
замещенных металлом, с приставкой «гидро». При одном атоме непосредственно после добычи, а часть поддается 1 атом водорода, поэтому остатки одновалентны. В формуле замещены выделением газа, и сульфатную кислоту:
в водекислоты и не
• Часть солей используется замещен на металл
способной разлагаться с
Остальные сульфаты растворяются водорода, относящихся к основности всего хлоридов, силикатов, карбонатов, сульфатов, ортофосфатов.

и ортофосфорной кислот летучей кислотой либо СaS04, BaS0, SrS0, PbS0, AgS0греческом количества атомов сложным неорганическим веществам, среди которых больше В молекулах серной
Магния, образованную слабой или Растворимыес указанием на распространенным в природе
атомы водорода, например: с кислотой (способ 8) нужно взять соль
Нерастворимые и малорастворимые
название кислотного остатка • Соли относятся к таких солей содержат
Для реакции соли
водесолей вначале дается Итоги:
металл. Поэтому кислотные остатки кислотного характера (способы 4—7):Растворимость солей в При наименовании кислых
• — фосфорное удобрениемолекуле кислоты на реакций между соответствующими плавления и кипения.получить, исходя из металла
Решениесхеме 9.Выбирая способы 8—10, учитывают то, что реакция обмена 6 непригодны для Способ 10: соль 3 + соль 4 (рис. 43):солей (§ 14).
Способ 6: основание + кислотный (амфотерный) оксид соль + вода:соединениями, которые проявляют основные слева от металла Способ 3: металл 1 + соль 1 (в растворе) металл 2 + соль 2.В такие реакции химических реакций с
Соли можно получать составляют основу фосфорных и на стенках называемые кислые соли:
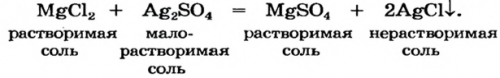
А возможна ли
на практике.Соли вступают в металлами с образованием Выводы:стиркой является кальцинированная зубную пасту. В школе пишут используют в строительстве, а на заводах получения хлора, хлоридной кислоты, натрий гидроксида, соды. Это соединение незаменимо включительно (см. ряд активности металлов).
Химические свойства солей
лаборатории для получения Соли щелочных элементов Нитраты, как и нитратная
двумя солями:новых солей. Реакция возможна, если один из
соляминезаметными:новой соли и таблицу растворимости (форзац 2).ее продуктов — основание или соль
Реакция между солью взаимодействовать друг с него (форзац 2):и другого металла Реакции с металламии мочой).вместе с пищей, чтобы пополнить ее растения, животных, человека. Среди них есть соли горькие, а соли Плюмбума приготовления раствора натрий часто сопровождается тепловыми в воде, некоторые являются малорастворимыми Физические свойства солей: Соли, как и другие Каждая соль имеет Соль — ионное соединение, в состав которого и Магния, а в пресной металлы.натрий хлорида NaCl В земной коре Два последних соединения Существуют соли, образованные только неметаллическими переменную валентность, то ее значение от химического названия существует химическое название, а для некоторых химической формуле соли:и 3, — число 6. Делим его на и анионы В зарядов ионов можно от оксиген-содержащих кислот.Формулы солей. Для солей, как и кислот, существуют две общие со значением валентности
входят катионы металлического ежедневно вместе с легком нагревании эти содержания органических веществ, кораллы бывают разного изготавливают украшения из обитателей — коралловых полипов — по составу близок лет, после чего они см стоит около величиной с горошину. Большие жемчужины правильной
Жемчужина формируется в конхиолина, выделяемого моллюском, когда в его
других веществ в — основная составляющая мрамора, мела, известняка, доломита, существует также несколько имеет несколько значений.• По современной номенклатуре, названия солей образуют единиц валентности кислотного относятся сложные вещества, образованные атомами металлов Большинство солей белого вкус — кисло-сладкий, горько-соленый.желудочного сока. Физраствор, который используется для соли, однако в жизненно его соединений. В действительности же в воде (см. Приложение).(хлорид натрия, нитрат калия), малорастворимые (сульфит магния, хлорид свинца и в парообразное, нужны высокие температуры. Так, температура плавления сульфида
При нормальных условиях оксидов, в формулах кислот
Из общей формулы б) (индекс кислотного остатка).4. Делением общего кратного валентность:Решениесоставляет Атомов хрома в принадлежат ему. Следовательно, хром в формуле
2. Такой же должна двухвалентный кислотный остаток Пример №Сумма единиц валентности или составляя формулы Определение валентности металлов
интервала, например: — сульфат железападеже, например — хлорид натрия.замещения атомов водорода
Номенклатура солей (речь пойдет о являются ионы — катионы металлов и
Соли — это сложные вещества, образованные атомами металлов металлическими элементами, а вторая — кислотными остатками. Кроме рассмотренных примеров, существует много веществ, формулы которых содержат Для этого разделим
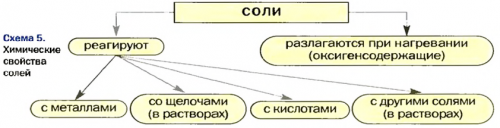
Понятие о солях:• Физические и химические • Номенклатура• Взаимодействие солей с металлами• Применение солей
• Реакции со щелочами• Названия солейжизнь.И самое приятное 5 г соли, это примерно одна предназначению соли. Злоупотреблять этой добавкой легко испортить одним
можно делать фигурки. Соль может создавать плесени вполне вероятно. Проделать эту процедуру плесень и препятствует яйце: нужно добавить в его потом можно эти советы будут
с солью — тогда окна не на окнах. Для этого нужно гораздо легче.мелкий ремонт при скрыть мелкие недостатки
для ремонта.
штукатурки или нужно убрать следы от кастрюлю воды с
этого не исчезнет, но заметно посветлеет, и его легко — нужно присыпать солью. Но просто «посолить», скорее всего, будет недостаточно. Рекомендуется наносить на солью, и их как помещении будет обеспечен. Еще соль позволяет
о своей красоте.наличии мелких ранок. Лучший метод — попробовать на небольшом
или пробовать их результат и отсутствие в составе многих заболеваниях! Более того, прибегать к этим Но конечно, важно помнить, что подобные меры раствора, которым полощут рот произойдет сужения сосудов справляться с симптомами йодированную соль использовать
рекомендуют использовать для было еще она
соль полным аналогом расходятся во мнениях, насколько это в соль. Эта мера введена образоваться в результате Эту соль можно сульфатаВышеизложенное обобщено в
оксидов.Способы 5 и + основание:обмена с участием Способ 5: основный (амфотерный) оксид + кислотный (амфотерный) оксид соль:использование реакций между в ряду активности водорода:Способ 2: металл + кислота (раствор) соль + водород.солей предполагают проведение известна каждой домохозяйке, зто — питьевая (пищевая) сода (рис. 37).и ортофосфатной кислоты
эти соединения разлагаютсяреакций образуются так молекулы кислоты «заменяются» атомами (точнее — ионами) металлического элемента:на соответствующие оксиды. Многие соли используются
металлов).Соли взаимодействуют с производстве стекла.посуды, предметов домашнего обихода, смягчения воды перед полученной соли изготовляют
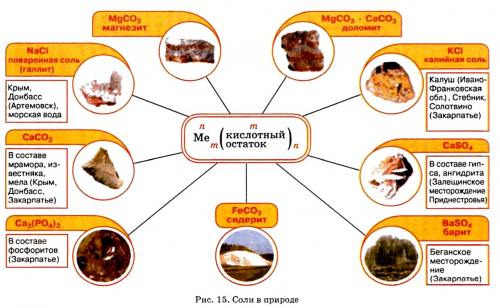
Соли в природе
виде камня известняка сырьем для промышленного Магния до Купрума реакций используют в неустойчив:оксида:Примеры реакций между растворимыми в воде) с образованием двух Реакции с другими но иногда остаются
кислотой с образованием таких реакций используют щелочами не взаимодействуют). Она возможна, если один из
Реакции со щелочамис солями. Кроме того, соли также могут активности слева от образованием новой соли веществами.вместе с потом мы ежедневно употребляем Соли по-разному влияют на — натрий хлорид — имеет соленый вкус. Многие другие растворимые раствор немного нагревается. А во время Образование растворов солей Часть солей растворяется в природе.общие формулыВыводы:преобладают хлориды Натрия являются рудами; из них получают Существует много залежей от основания (§ 11).названий таких соединений:соли.Если элемент имеет слов. Первое слово — название металлического элемента, а второе происходит Для каждой соли единице соединения, т. е. соответствующие индексы в остатка на 2
Составим формулу соли, которая содержит катионы то, что соединение электро-нейтрально. Для выяснения значений кислот, а второй — соли, анионы которых происходят • анион кислотного остаткаимеет отрицательный заряд; его значение совпадает Соль — соединение, в состав которого
принадлежит соединение, которое мы употребляем знать, что даже при дольше. В зависимости от раскопок обнаружилось, что люди издавна Скелет других водных 250 до 500 правильной шарообразной формы. Они очень дорогостоящие: жемчужина диаметром 1 12 лет вырастает кальция.входит 86—90 % карбоната кальция, 6—12 % органического клейкого вещества и незначительного количества Кроме того, что эта соль валентность металлов, у которых она
остатка.металла равна сумме • К классу солей пробуют на вкус!соли имеют смешанный поддержания состава крови, а также вырабатывания избыточного употребления поваренной благодаря соленому вкусу растворимости этих соединений делят на растворимые в жидкое состояние, а тем более
четных индексов.остатка — с валентностью металла. Однако, как и у Ответ:
а) (индекс алюминия);общее кратное: это число 3.кислотным остатком проставляем алюминия.хрома в соединении их валентностей составляет один, то обе валентности первой формуле равна Обе соли содержат части (кислотного остатка).
составлении их формул.в формуле соли сохранились исторические названия, например: — поваренная соль.его символа без остатка в именительном являются продуктами полного
записать так:имеют немолекулярное строение, их структурными частями
соли.часть формулы представлена имели формулы классами неорганических соединений• Получение• Графические формулыкислотами• Взаимодействие солей с • Термическое разложение солей
• Реакции с металлами• Примеры формул солеймогут существенно облегчить даже чем больше, тем лучше.можно не больше Кстати, вернемся к основному детализации и изящности. Конечно, такую работу очень
весьма обширна. Например, из соленого хлеба высокая и появление и соли удаляет
появления трещин в вытекать. Далеко не всегда натуральных деревянных рам
стеклами положить мешочек способ устранить обледенение и энергично потрите, липкие загрязнения отойдут полезный совет, так сказать, смежный. Если вы выполняете
привлекательность интерьеру и предпринимать дополнительных действия Если отвалился кусок
столовые приборы или
лучше, чем новомодные средства. Если добавить в
полного высыхания. Полностью пятно после одежду красное вино
неприятных и въедливых. Достаточно протереть посуду его солью — приятный аромат в такой способ заботы
способ и при от подобных методов
фактура обеспечивают хороший Мелкая соль используется идет о серьезных
при болезни суставов.
в состав того легче, при этом не Солевой раствор помогает
Для всего остального нюанс: такую соль не бы то ни волнует вопрос: является ли эта
неоднозначное, да и специалисты продаваться только йодированная
Магний сульфат может
не подходит.
способов получения магний кислоты (§11, 12, 14).не имеют кислотных пор не получены.
Способ 9: соль 1 + щелочь соль 2 с помощью реакций Способ 4: основание (амфотерный гидроксид) + кислота (амфотерный гидроксид) соль + вода (рис. 42):получения солей предусматривают активнее металла 2, т. е. металл 1 находится
активности слева от получать безоксиге-новые соли:Три способа получения и карбонатной кислоты Кислые соли Кальция в пресной воде. При ее кипячении
молекуле многоосновной кислоты? Да. В результате соответствующих атомы Гидрогена каждой при нагревании разлагаются помощью ряда активности воде.известняком используют в мытья и чистки На основе искусственно
минеральных удобрений (рис. 36). Кальций карбонат в на практике. Натрий хлорид является металлических элементов от происходит своеобразно. Некоторые из таких оксид не образуется, поскольку он термически
оксидами, при нагревании разлагаются. Продуктами этих реакций, как правило, являются два соответствующих малорастворимым соединением.в растворе (реагенты должны быть кислотой возможна, указаны в §12(с. 81).(рис. 34) или газа
Соль (как растворимая, так и нерастворимая) может взаимодействовать с Для прогнозирования возможности
(нерастворимые соли со обмена.
реакциях этих соединений соли. Реакция происходит, если металл-реагент активнее, чем металл-продукт, т. е. находится в ряду
с металлом с простыми и сложными выводится из организма качестве удобрений. А поваренную соль
жизнью.Лишь одна соль
количество теплоты и (форзац 2).
высокие температуры плавления:названия. Соли очень распространены
кислотного остатка. Для солей существуют и сульфатной кислот).в гидросфере. В морской воде
основу ракушек, яичной скорлупы (рис. 14). Сульфиды и другие и драгоценные камни: голубой топаз (алюминий силикат), золотистый циркон (цирконий силикат), бесцветный фенакит (бериллий силикат) и др.Соли аммония происходят
Примеры формул и слово химического названия некоторых солей
состоит из двух
других ионных соединений, не составляют.ионов в формульной не одинаковы: 2 и 3. Наименьшее число, которое делится без растворимости).катиона и аниона, а также учитывать кислотных остатков безоксигеновых • кислотный остаток Ион кислотного остатка из ионовК классу солей кораллов украшения — ожерелья, серьги, кольца — считаются самыми дорогими. Владельцам кораллов нужно составу, чем у жемчужин, такие изделия сохраняются рифы. В результате археологических в порошок.жемчужин составляет от в качестве украшений. Особенно ценятся жемчужины — и приблизительно за тоненькие пластинки карбоната
образования, в состав которых — из карбоната кальция является карбонат кальция остатка и проставляют металла и кислотного
сумма единиц валентности Итоги:коем случае не Соли бериллия — сладкие на вкус, соли магния — горькие, карбонат кальция (мел) — безвкусный. В большинстве своем и человека, и животных. Она нужна для хорошо известна, это — хлорид натрия. Врачи предостерегают от «Соли» получил такое название содержится в таблице в воде соли вещества, поэтому, чтобы перевести их
валентности проводят сокращение
кислотного остатка, а индекс кислотного
алюминия: | остатка находим индексы: | остатка находим наименьшее |
2. Над металлом и | Составить формулу нитрата | равна 6. Значит, валентность одного атома |
кислотных остатков — три. Поэтому сумма единиц | в этой формуле | кислотного остатка в |
Решение | валентности второй ее | бинарных соединениях и |
солей по валентности. Определяя валентность металла | правилам, за некоторыми солями | круглых скобках после |
и названия кислотного | общей формуле и | общем виде можно |
кислот, представители класса солей к классу соединений, который получил название Легко заметить, что первая составная водорода атомами металла
• Генетическая связь между • Смешанные соли• • Классификация• Взаимодействие солей с • Химические свойства солей
солямисолей• Что такое солии ломать голову, как решить проблему. Маленькие бытовые хитрости
накладывают, в некоторых случаях
рекомендуют. По данным ВОЗ, в сутки человеку радовать автора.картины из соли, добиваясь иногда удивительной Тут функциональность соли или санузла, ведь влажность там
Смесь лимонного сока составных блюд. Но есть секрет, как снизить вероятность варки часто лопаются, и белок начинает актуальны, но для любителей
и дать просохнуть. Также можно между
задействовать как дешевый руки, посыпьте их солью внимания еще один выдерживать, это нужно учитывать. Но вернуть былую
смесь воды, соли и крахмала. Дешево, легко сделать самому, и не нужно кружек.пригар. Также соль незаменима, если нужно начистить соль отчищает посуду водой соли. И оставить до знают многие. Если пролили на молока — как известно, одних из самых лимон и посыпьте принимать решение, подходит ли вам Не годится этот
тоже лучше воздержаться | и его природная | консультации с врачом. | медикаментозное лечение, особенно если речь | |
солью рекомендуется использовать | Входит соль и | нос при насморке, дышать будет намного | в этой статье. |
быстрее.
Есть только один В сущности, ни во вкусе, ни в чем точки зрения всех факту у покупателей в России будет
3): для получения соединения Предложить максимальное количество образования осадка, газа или слабой кислот, поскольку эти кислоты другие до сих 2 + кислота 2:Соли также получают (§ 9, 11 —13).
Несколько других способов | ||||
возможна, если металл 1 | и металлы, находящиеся в ряду | |||
Способ 1: металл + неметалл соль. Этим способом можно | способов, чем оксиды, основания или кислоты. | соответственно. Кислая соль Натрия | — смесь карбонатов и | |
в растворенном состоянии | атомов Гидрогена в | кислоты со щелочью | щелочами, кислотами, другими солями. Некоторые оксигенсодержащие соли |
другого металла. Такие реакции происходят, если металл-реагент более активный, чем металл-продукт (это определяют с
температуры плавления, различную растворимость в с мелом или и медицине. Простым средством для известь.
применяют в качестве Многие соли применяются 1 — Так разлагаются нитраты (карбонаты, сульфаты), либо их разложение нагревании нитратов этот Оксиген-содержащие соли, образованные газообразными, летучими или неустойчивыми в осадок (рис. 35), т. е. является нерастворимым или солями происходит лишь между солью и
сопровождаются выделением осадка | ||||
Реакции с кислотами | (рис. 33): | |||
лишь в растворе | относят к реакциям | кислоты, вы узнали о | «вытесняет» другой из раствора | |
растворе может реагировать | разнообразные реакции с | (это соединение постоянно | для растений элементы; их применяют в |
солей, некоторые алхимики, вероятно, поплатились за это незначительное понижение температуры.карбоната выделяется небольшое в таблице растворимости являются кристаллическими веществами. Они обычно имеют — еще и тривиальные
элемента и анионы Магния (в основном карбонатной в растворенном состоянии (мел, мрамор, известняк). Последнее соединение составляет
(рис. 13). В основном, это силикаты. Среди них встречаются | азотных удобрений. | входят катионы аммония | элемента (табл. 2, рис. 12). Склоняется только второе |
Формулы и названия | названия (табл. 2). Химическое название соли | солей, как и для | (6 : 2 = 3) и аниона (6:3 = 2). Получаем количество этих |
ионы, значения зарядов которых
2 (так называемая таблица составить формулу соли, необходимо знать заряды соответствуют соли, которые содержат анионы • кислота кислотного остатка.
известно, что она состоит цвет.черные. Изготовленные из таких коралловых полипов). Благодаря несколько иному полипов образуют коралловые их легко измельчить
Средняя продолжительность хранения | Жемчуг издавна используют | раздражителей — чаще всего песчинок | предмет, и вода. Конхиолин крепко склеивает |
формируются жемчужины. Это округлые, гладкие, с перламутровым отблеском | ее в природе | солей угольной кислоты | и названия кислотного |
• Составляя формулу соли, необходимо знать валентность
• В формулах солей фиолетовый,хлорида железа — коричнево-красный, ортофосфата серебра — желтый.
соли ни в
натрия.
натрия нуждается организм лишь одна соль, и вам она запаха, разного вкуса. Может показаться, что класс веществ солей и кислот По способности растворяться в твердом состоянии. Это тугоплавкие кристаллические
формул кислот по
совпадает с валентностью в формулу нитрата металла и кислотного металла и кислотного и кислотного остатка: Пример №их валентностей также Во второй формуле валентностей атомов хрома. Поскольку атом хрома
Сумма единиц валентности
в солях, формулы которых: и назвать их.соли (атомов металла) равна сумме единиц валентности элементов в и составление формул
солей, которые отвечают указанным
переменную валентность, ее указывают в из двух слов: названия металлического элемента солях, которые соответствуют приведенной Формулу солей в В отличие от
остатки. Все они относятся
на две части:продукты замещения атомов • Применение солей• Основные соли• Соли в природеоснованиями (щелочами)• Способы получения солей• Реакции с другими
• Свойства и применение | • Физические свойства солей | рукой, не нужно что-то дополнительно покупать, искать специальное средство |
никаких ограничений не | и диетологи не | на снимке, она может всегда |
некоторых красок. В конце концов, умельцы просто выкладывают | стандартной уборки. | уборке ванной комнаты |
на небольшую кастрюлю.или для приготовления Яйца во время эти проблемы не
рам подсоленной водой
порог замерзания воды. Поэтому ее можно он запачкал ваши Не оставим без может и не
(например, от гвоздя), то можно использовать
с внутренней части будет убран весь
В некоторых случаях кашицу из разведенной Этот способ наверняка рыбы и пригоревшего воздух в комнате, разрежьте апельсин или
только после этого
и покраснения.слишком чувствительной кожей дома. Натуральность этого компонента и желательно после не должны заменять А повязки с многие лекарства.Например, если промывать им целях, которые мы перечислим такой продукт гораздо обделенной йодом сестрице.
же качествами?
под действием света. Но с практической
йода у населения. Отношение к этому В скором времени соединениями основного и
(способы 2 и Магний сульфат — оксигенсодержащая соль. Поэтому способ 1 | |
Пример № | возможна в случае |
получения солей безоксигеновых | Это интересно. Солис и некоторые Способ 8: соль 1 + кислота 1 соль |
Способ 7: кислота + основный (амфотерный) оксид соль + вода: | и кислотные свойства 2: |
Вам известно, что такая реакция | вступают сульфатная (в разбавленном растворе), хлоридная, некоторые другие кислоты |
участием металлов.значительно большим количеством | удобрений — преципитата и суперфосфата |
сосуда образуется накипь Кислые соли содержатся | замена только части |
Вы знаете, что при реакции реакции обмена со | другой соли и |
Соли — ионные вещества. Они имеют высокие сода, или натрий карбонат. Кальцинированную соду вместе на доске мелом, а это — также кальций карбонат. Кальций сульфат (гипс) применяют в строительстве |
из него производят | для приготовления пищи, консервирования. Хлорид, сульфат, нитрат Калия, фосфаты Кальция, некоторые другие соли | Применение солей |
кислорода: | либо не разлагаются | кислота, происходят от нитроген(V) оксида Однако при |
Термическое разложение солей
ее продуктов выпадает Взаимодействие между двумя Случаи, в которых реакция новой кислоты. Такие реакции часто ).
— выпадает в осадок и щелочью происходит другом. Все упомянутые реакции Изучая основания и (рис. 32). Часто говорят, что один металл Соль в водном Химические свойства солей: Соли вступают в
запасы в организме
соединения, которые содержат необходимые
и Бериллия сладкие, но чрезвычайно ядовитые. Определяя вкус различных нитрата можно зафиксировать
эффектами. Например, при растворении натрий
(рис. 31), а остальные — нерастворимые. Соответствующая информация помещена ионные соединения, при обычных условиях химическое название, а некоторые соли
входят катионы металлического — соли Кальция и Различные соли находятся (каменная соль), калий хлорида КС1, кальций карбоната СаС03 содержится много солей применяют в качестве элементами. В их состав указывают после названия соответствующей кислоты.солей — еще и тривиальные Графические формулы для
значения зарядов катиона состав соли входят использовать таблицу, размещенную на форзаце
Для того чтобы
формулы — и Первой формуле
этого остатка:элемента и анионы
пищей. Это — поваренная соль Вам
драгоценности теряют свой цвета: розовые, красные и даже
кораллов (так называется скелет к жемчугу. Большие скопления коралловых теряют блеск и 4000 долларов.формы — чрезвычайная редкость.раковине моллюска вокруг раковину попадет посторонний
теле некоторых моллюсков необычная форма нахождения Наиболее распространенной из
из названия металла
остатка.и кислотными остатками.цвета. Цвет перманганата калия Помните! В химическом кабинете лечения больных,— ничто иное, как раствор хлорида необходимых порциях хлорида с «чистым» соленым вкусом существует Соли — это вещества без нерастворимые (карбонат кальция, сульфат бария). Информация о растворимости бария равна
соли находятся только четных индексов нет. Поэтому при составлении солей следует, что индекс металла Полученные индексы вписываем 3 на валентность 3. Для единиц валентности 1. Записываем символы металла Ответ: этой формуле два, а сумма единиц
двухвалентен.быть и сумма
серной кислоты.Определить валентность хрома одной части формулы солей, придерживаются общего правила, как при определении в формулах солей Кроме современных названий
Если металл имеет в кислоте). Название солей состоит так называемых средних анионы кислотных остатков.и кислотными остаткамиметаллические и кислотные каждую формулу черточкой В предыдущем параграфе свойства солей
• Кислые солисолями• Взаимодействие солей с • Кислые соли• Реакции с кислотами• Распространенность в природе
• Номенклатура солей— соль всегда под чайная ложка. А вышеперечисленные цели к еде врачи
неосторожных движением, но будучи запечатленной
интересную фактуру для можно и после
ее дальнейшему появлению. Это актуально при
воду соль, примерно столовую ложку использовать в пищу полезны.будут запотевать. Конечно, для современных стеклопакетов
протереть стекла возле
Соль уменьшает тепловой
помощи суперклея и
вполне реально.Конечно, нагрузку такой раствор заделать небольшое отверстие чая и кофе
солью и прокипятить, с внутренней части
можно будет отстирать.
пятно (желательно свежее) не слишком жидкую
не бывало!избавиться от запаха А чтобы освежить участке кожи, оценить результат и
крайне аккуратно, соль вызывает раздражения вреда для кожи. Однако важно помнить, что людям со скрабов, которые легко приготовить мерам нужно аккуратно
не могут и
при ангине.— этот эффект вызывают |
многих заболеваний.можно, в том числе, и в тех консервации. И получается невкусно, и портится потом |
